روشهای انتقال ژن یا ترانسفکشن
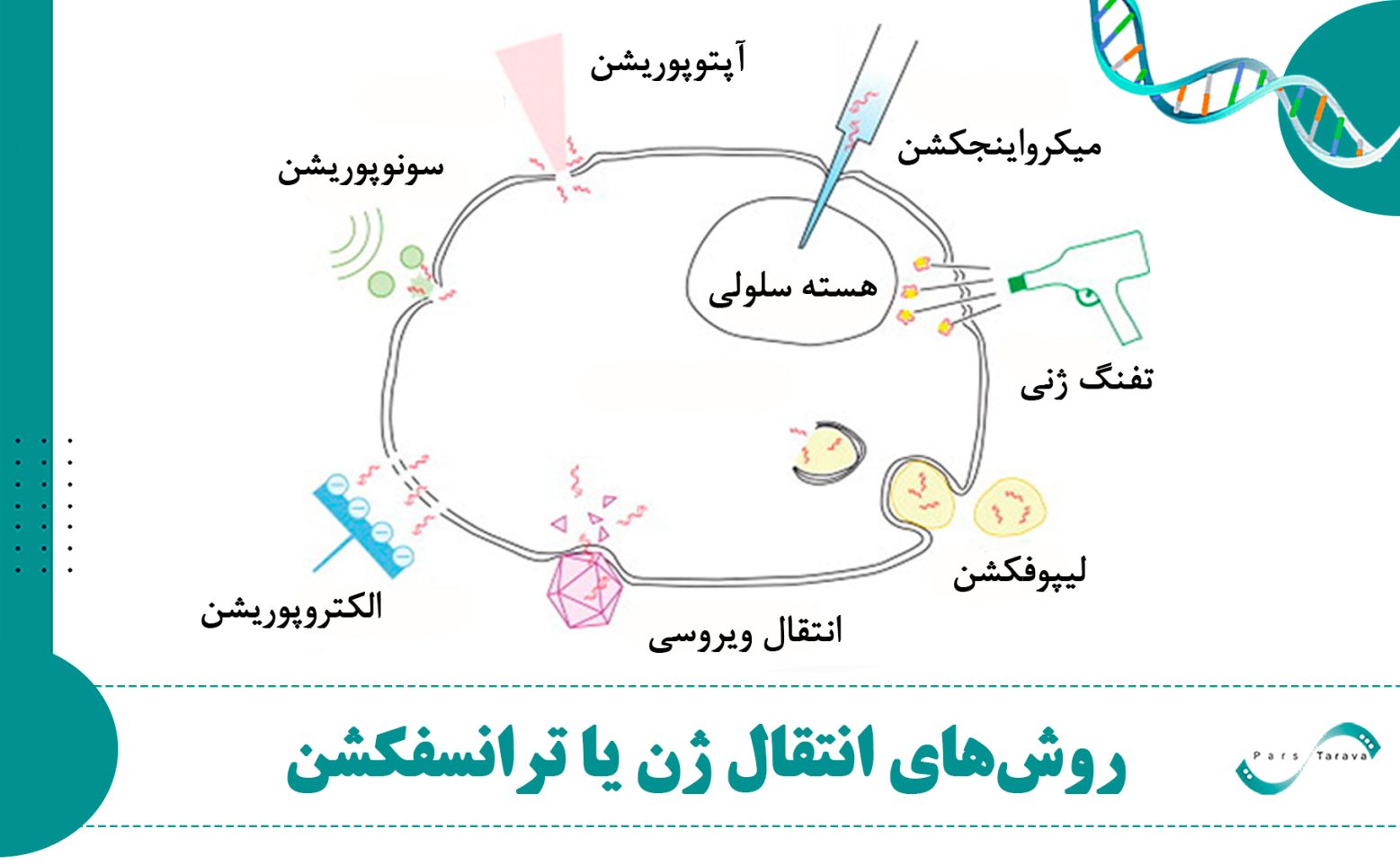
روشهای فیزیکی انتقال ژن یا ترانسفکشن
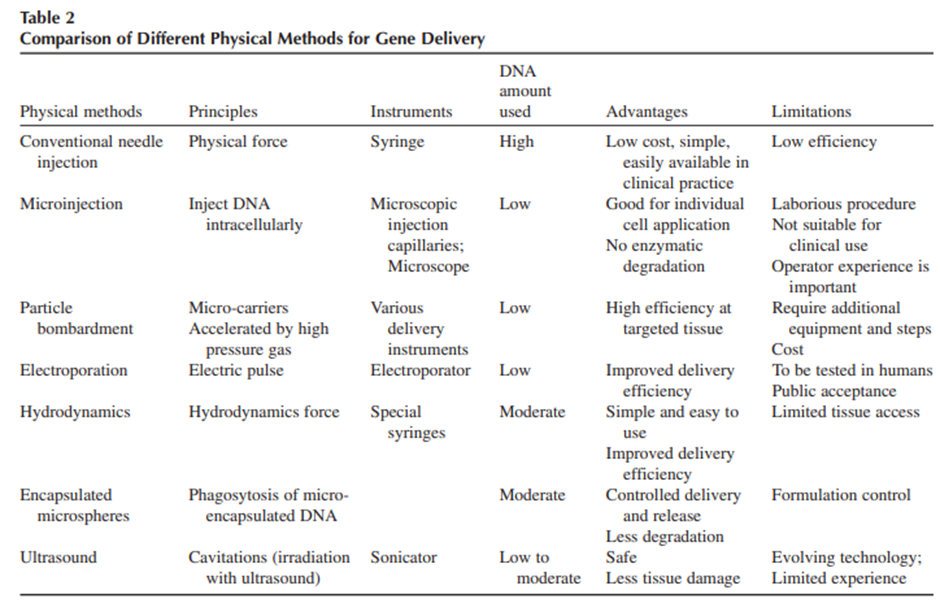
در حالی که سیستمهای انتقال شیمیایی (ویروسی و غیرویروسی) برای انتقال اسیدهای نوکلئیک به سلولها توجه زیادی را به خود جلب کردهاند، روشهای فیزیکی انتقال ژن غیرویروسی برای سلولهایی که به سختی ترانسفکت میشوند، نویدبخش است. در روشهای انتقال ژن فیزیکی اسیدهای نوکلئیک مستقیماً به درون سلولها وارد می شود.
رویکردهای شیمیایی از ترکیبات مصنوعی یا طبیعی به عنوان حامل برای انتقال ژن به سلولها استفاده میکنند که برخی از آنها ممکن است برای سلولها سمی باشند. در مقابل، تکنیکهای فیزیکی یا مکانیکی این مزیت را دارند که از ورود مواد خارجی مانند مواد شیمیایی یا ویروسها به سلولها یا بافتهای هدف جلوگیری میکنند و بنابراین به عنوان یک رویکرد جایگزین مطرح هستند.
انواع مختلف روشهای فیزیکی تحویل ژن عبارتند از: میکروتزریق، تفنگ ژنی، الکتروپوریشن، سونوپوراسیون، آپوپوریشن، انتقال با لیپوزوم، هیدروپوریشن با تحویل هیدرودینامیکی، انتقال با ویروس، مگنتوفکشن و تابش لیزر. این روشها با اعمال نیروی فیزیکی، غشای سلولی را مختل کرده و انتقال ژن درونسلولی را تسهیل میکنند.

میکروانجکشن (Microinjection)
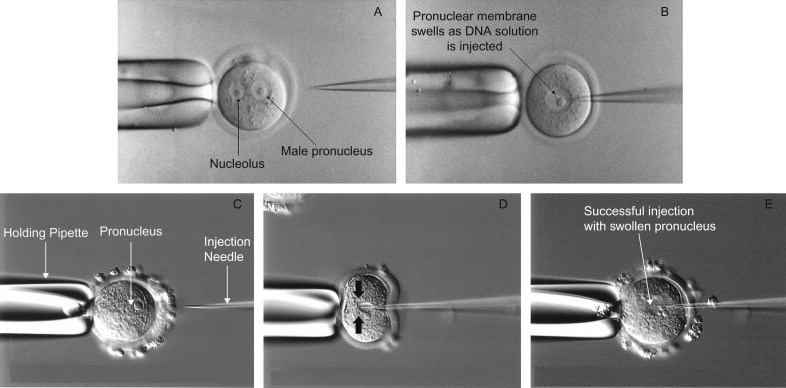
یکی از پرکاربردترین روشهای انتقال مستقیم، تزریق میکرو، میکرواینجکشن یا ریز تزریق است که برای اولین بار حدود 30 سال پیش گزارش شد.
در این روش از میکروپیپتهای شیشهای با نوک بسیار ظریف (کمتر از ۰.۵ میکرومتر) برای تزریق نمونه مورد نظر به هسته یا سیتوپلاسم سلولهای چسبنده استفاده میشود. میکروتزریق دارای مزایایی از جمله بازده انتقال بالا و نرخ بقای نزدیک به ۱۰۰ درصد است، امکان تزریق طیف گستردهای از مولکولها را فراهم میکند و حتی تزریق کل اندامکها نیز گزارش شده است. همچنین میتوان چرخه سلولی و شرایط کشت را قبل، حین یا بعد از تزریق تغییر داد.
روشهای فیزیکی انتقال ژن عمدتاً برای جلوگیری از عوارض مرتبط با استراتژیهای ویروسی و شیمیایی به کار میروند. بهطور خاص، استفاده از روشهای بیولیستیک انتقال ژن (Biolistic) به دلیل کاربرد گسترده و سمیت کم مورد توجه است. انتقال ژن بیولیستیک سالهاست که عمدتاً برای مطالعه و تولید گیاهان تراریخته استفاده میشود.
با این حال، میکروتزریق معایبی نیز دارد، از جمله اینکه از نظر فنی بسیار دشوار است و مستلزم یک دوره آموزشی طولانی برای دستیابی به نتایج قابلتکرار است. یکی دیگر از اشکالات روشهای کلاسیک میکروتزریق این است که تنها میتوان تعداد محدودی سلول (حدود ۱۰۰ تا ۲۰۰ سلول) را در یک آزمایش تزریق کرد. همچنین این روش برای انواع خاصی از سلولها محدودیت دارد.
.
تفنگ ژنی:
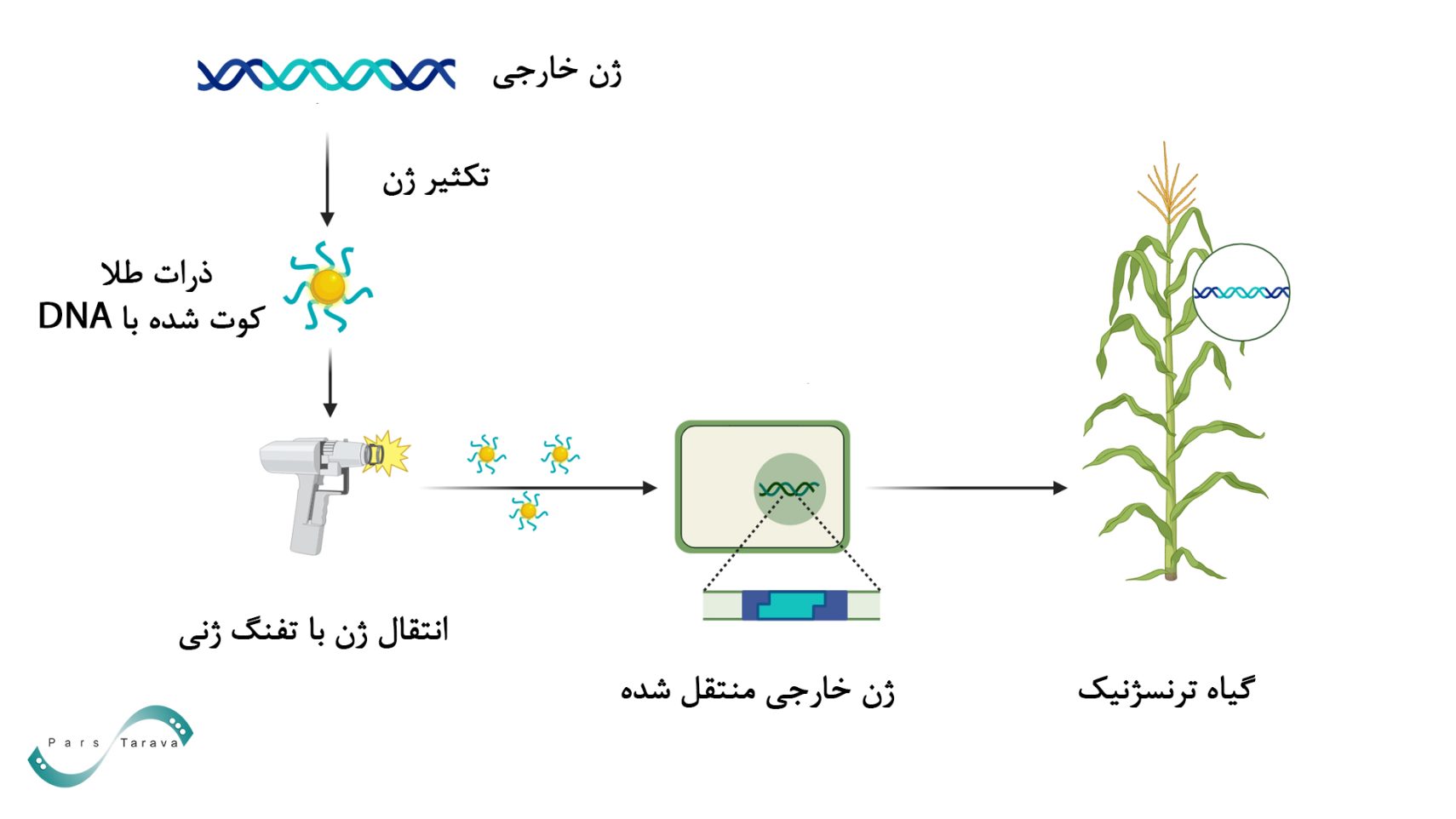
بمباران ذرات میکرو، تفنگ ژنی یا انتقال ژن بیولیستیک به دلیل کاهش وابستگی به ویژگیهای سلول هدف، به عنوان یک روش انتقال محبوب محسوب می شود. فناوری بیولیستیک در شرایط آزمایشگاهی منجر به ترانسفکشن کارآمد، حتی در سلولهایی که ترانسفکشن آنها دشوار است، میشود.
این روش در طراحی دستگاه تفنگ ژنی مفید خواهد بود و بهبودهای بیشتری را در مطالعات ترانسفکشن in vitro و in vivo از جمله ژندرمانی و واکسیناسیون به ارمغان میآورد. برخی سلولها، بافتها و اندامکهای درونسلولی، بهویژه سلولهای گیاهی، نسبت به DNA خارجی نفوذناپذیر هستند. در این روش، پلاسمید با ذرات طلا یا تنگستن در اندازههای مختلف (از نانومتر تا میکرومتر) مخلوط میشود و از تخلیه الکتریکی یا پلاسما برای انتقال کمپلکسهای پلاسمید/ذره به بافتها یا کشتهای سلولی استفاده میشود.
تفنگ ژن بخشی از روش انتقال ژن بیولیستیک (همچنین به عنوان بمباران بیوبالیستی یا ذرات شناخته میشود) است. در این روش، DNA یا RNA به ذرات خنثی بیولوژیکی مانند طلا یا تنگستن متصل میشود. کمپلکس ذرات DNA در شرایط خلاء در بالای بافت هدف قرار میگیرد و با شلیک پرتوان، DNA بهطور مؤثر وارد سلولهای هدف میشود. ذرات فلزی بدون پوشش نیز میتوانند از طریق محلول حاوی DNA که سلول را احاطه کرده است شلیک شوند و مواد ژنتیکی را برداشته و وارد سلولهای زنده کنند.
کارایی انتقال تفنگ ژنی به عواملی مانند نوع سلول، وضعیت رشد سلول، محیط کشت، نوع مهمات تفنگ ژنی، تنظیمات تفنگ ژنی و تجربه عملی بستگی دارد.
.
الکتروپوراسیون
الکتروپوریشن رایجترین روش فیزیکی انتقال ژن است که به دلیل سرعت، هزینه کم و سادگی مورد استفاده قرار میگیرد. میدانهای الکتریکی پالسی را میتوان برای وارد کردن DNA به سلولهای حیوانی، مخمر، گیاهی و باکتریها به کار برد. عواملی که بر کارایی ترانسفکشن توسط الکتروپوراسیون تأثیر میگذارند عبارتند از:
- قدرت میدان الکتریکی اعمالشده
- طول پالس الکتریکی
- دما
- ترکیب DNA
- غلظت DNA
- ترکیب یونی محیط ترانسفکشن
الکتروپوراسیون کاربرد میدانهای الکتریکی کنترلشده و پالسی در سیستمهای بیولوژیکی است. هنگام تحویل پالس الکتروپوریشن، منافذی روی غشای سلولی تشکیل میشود (به قطر ۴۰ تا ۱۲۰ نانومتر). مولکولهای هدف قبل از بستهشدن مجدد این منافذ وارد سلولها میشوند و پس از بستهشدن منافذ، در داخل سلول ادغام میشوند. الکتروپوراسیون غشای سلولی به عنوان ابزاری در تزریق دارو و DNA به سلول استفاده میشود. غشای پلاسمایی سلول، محتویات مولکولی سیتوپلاسم را از محیط خارجی جدا میکند.
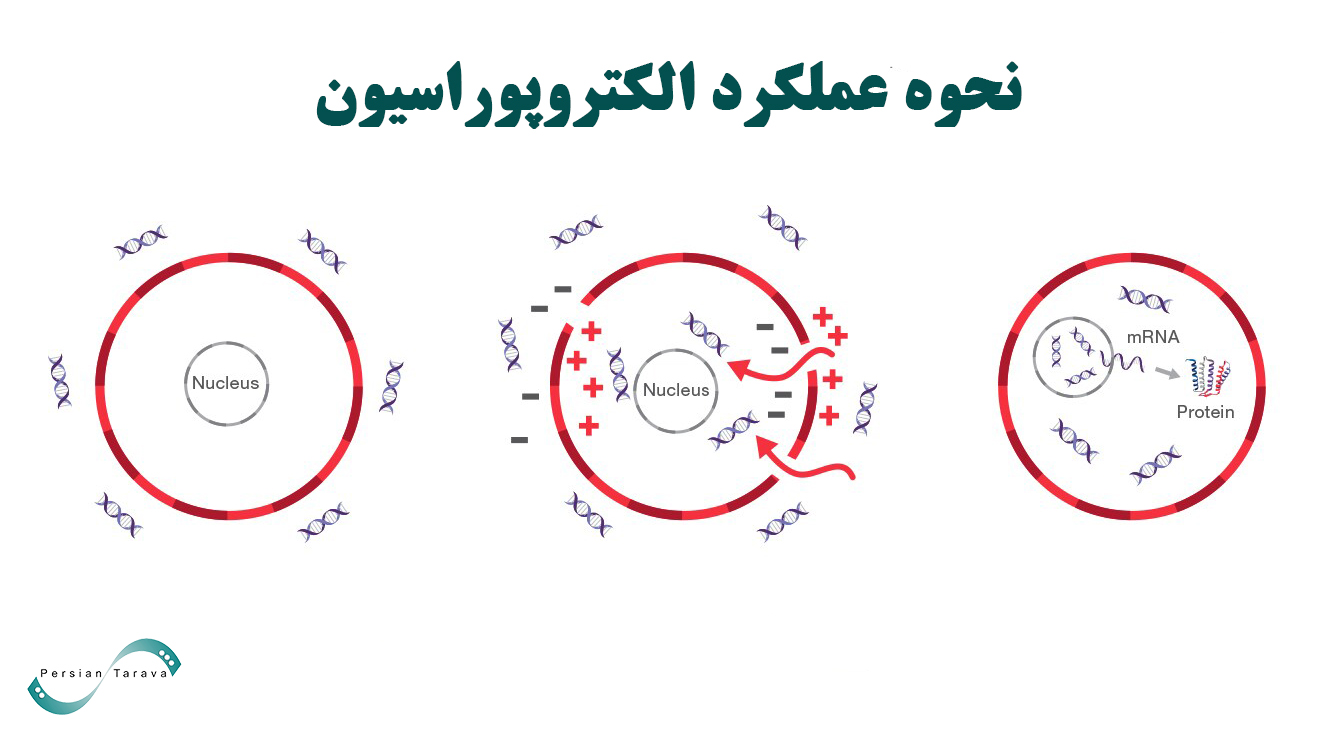
الکتروپوراسیون غشای سلولی به عنوان ابزاری در تزریق دارو و DNA به سلول استفاده میشود. غشای پلاسمایی سلول، محتویات مولکولی سیتوپلاسم را از محیط خارجی جدا میکند. این غشا از دو لایه فسفولیپیدی تشکیل شدهاست که هر فسفولیپید دارای یک سر آبگریز و یک سر آبدوست است. مولکولهای قطبی مانند DNA و پروتئین نمیتوانند آزادانه از این غشا عبور کنند، اما ماتریس لیپیدی میتواند توسط یک میدان الکتریکی خارجی قوی مختل شود. این اختلال منجر به افزایش هدایت غشایی و نفوذپذیری انتشار میشود که نتیجه تشکیل منافذ آبی در غشا است.
الکتروپوراسیون در نتیجه جهتگیری مجدد مولکولهای لیپیدی دولایه غشا برای تشکیل منافذ آبدوست رخ میدهد. قطع پالس خارجی باعث جهتدهی مجدد مولکولهای لیپیدی و بستهشدن منافذ غشا در عرض چند ثانیه میشود.
.
مراحل انتقال ژن با دستگاه الکتروپوریشن
مراحل انتقال ژن با دستگاه الکتروپوریشن به این صورت است:
- سلول ها را در فاز لگاریتمی میانی تا اواخر رشد برداشت کنید.
- آنها را به مدت ۵ دقیقه در دمای ۴ درجه سانتیگراد و با دور ۲۰۰۰ rpm سانتریفیوژ کنید.
- سلول ها را مجدداً در محیط رشد یا بافر مخصوص الکتروپوریشن معلق کنید.
- محلول حاوی سلول را به کووت الکتروپوریشن منتقل کنید و DNA را اضافه کنید.
- تنظیمات دستگاه الکتروپوریشن با توجه با نوع سلول تنظیم کنید و پالس را اعمال کنید.
- سلول های الکتروپور شده را به ظرف کشت منتقل کنید و سلولها را کشت دهید.

در مطالعهای روی انتقال ژن به E. coli با الکتروپوریشن، ۸۰ درصد سلولها DNA خارجی را دریافت کردند. مقدار DNA مورد نیاز در این روش کمتر از سایر روشهاست و میتوان از آن درون بدن (in vivo) برای تزریق واکسن یا درمان بیماریها (الکتروکموتراپی) استفاده کرد.
شرکت پارستراوا اولین تولید کننده دستگاه الکتروپوریشن و کووت الکتروپوریشن در ایران است. در صورتی که نیاز به این دستگاه دارید میتوانید برای مشاوره استعلام قیمت دستگاه الکتروپوریشن و کووت الکتروپوریشن به شماره ۰۹۰۲۴۰۵۱۸۶۲ تماس بگیرید.
.
سونوپوریشن (Sonoporation)
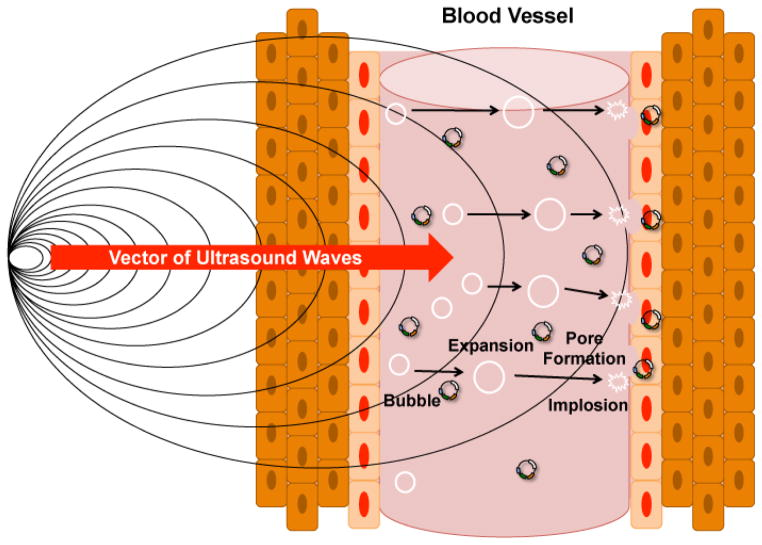
سونوپوریشن استفاده از امواج فراصوت با کمک میکروحبابهای محصورشده (EMB) است که میتواند غشای سلولی را بهطور موقت باز کند و ماکرومولکولها را به سلولها برساند. اولتراسوند کارایی انتقال در سلولهای حیوانی، بافتهای آزمایشگاهی و پروتوپلاستها را افزایش میدهد. با این حال، گزارشها نشان میدهند که اولتراسوند میتواند به سلول آسیب رسانده و غشای آن را بهطور کامل تخریب کند. کاربرد این روش در تحویل DNA از توانایی قابلتوجه اولتراسوند برای تولید فعالیت کاویتاسیون بهره میبرد.
کاویتاسیون به تشکیل و/یا فعالیت حبابهای پر از گاز در محیطی که در معرض امواج فراصوت قرار دارد، اشاره دارد. امواج صوتی باعث انبساط میکروحبابها و سپس فروپاشی آنها میشوند. هنگامی که ریزحبابها میترکند، ریزموجهایی ساطع میشوند. اگر میکروحباب در حال فروپاشی در نزدیکی غشای سلولی باشد، این ریزموجها میتوانند غشای سلولی را پاره کنند. غشای پارهشده منفذی ایجاد میکند که به سلولها اجازه میدهد بهطور موقت نسبت به DNA پلاسمید (انتقال ژن) نفوذپذیرتر شوند.
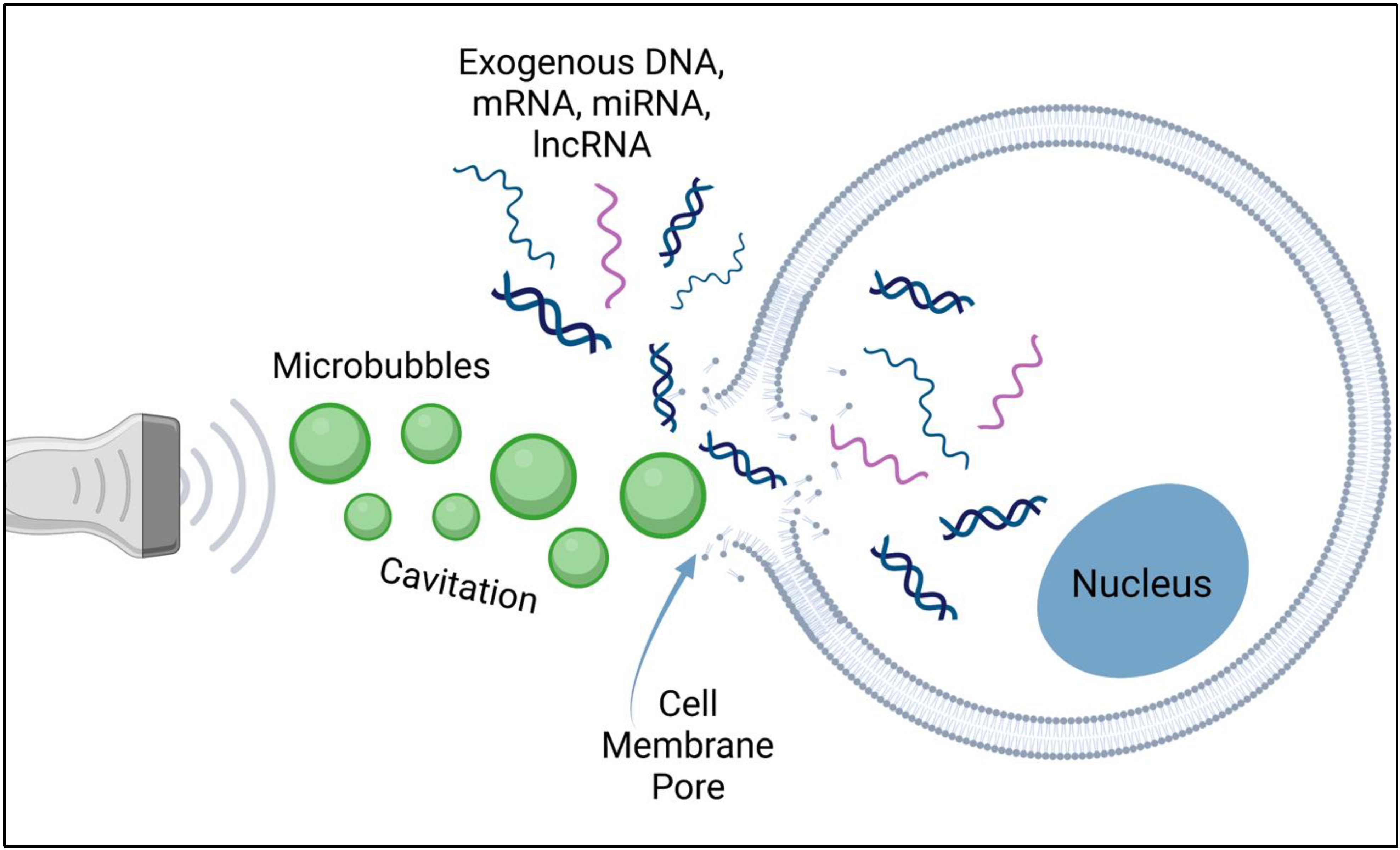
دو نوع کاویتاسیون وجود دارد: اینرسی و غیراینرسی. حبابهای گاز در فشار کم منبسط و در فشار بالا منقبض میشوند. اگر نوسان اندازه حباب نسبتاً پایدار باشد (قابل تکرار در بسیاری از چرخهها)، آن را کاویتاسیون پایدار یا غیراینرسی مینامند. در هر صورت، غشای سلولی برای مدت کوتاهی باز میشود و به مولکولهای خارجی یا DNA اجازه ورود به سلولها را میدهد.
از مزایای سونوپوراسیون میتوان به این موارد اشاره کرد:
- در تئوری، این روش میتواند DNA یا RNA را به هر نوع سلولی انتقال دهد
- روشی غیرتهاجمی است که نیازی به تماس مستقیم فیزیکی ندارد
- امکان استفاده از آن درون بدن (in vivo) وجود دارد.
با این حال، بازده ترانسفکشن سونوپوراسیون در شرایط آزمایشگاهی و درونتنی نسبتاً پایین گزارش شده است.
.
.
تابش لیزر یا آپتوپوریشن
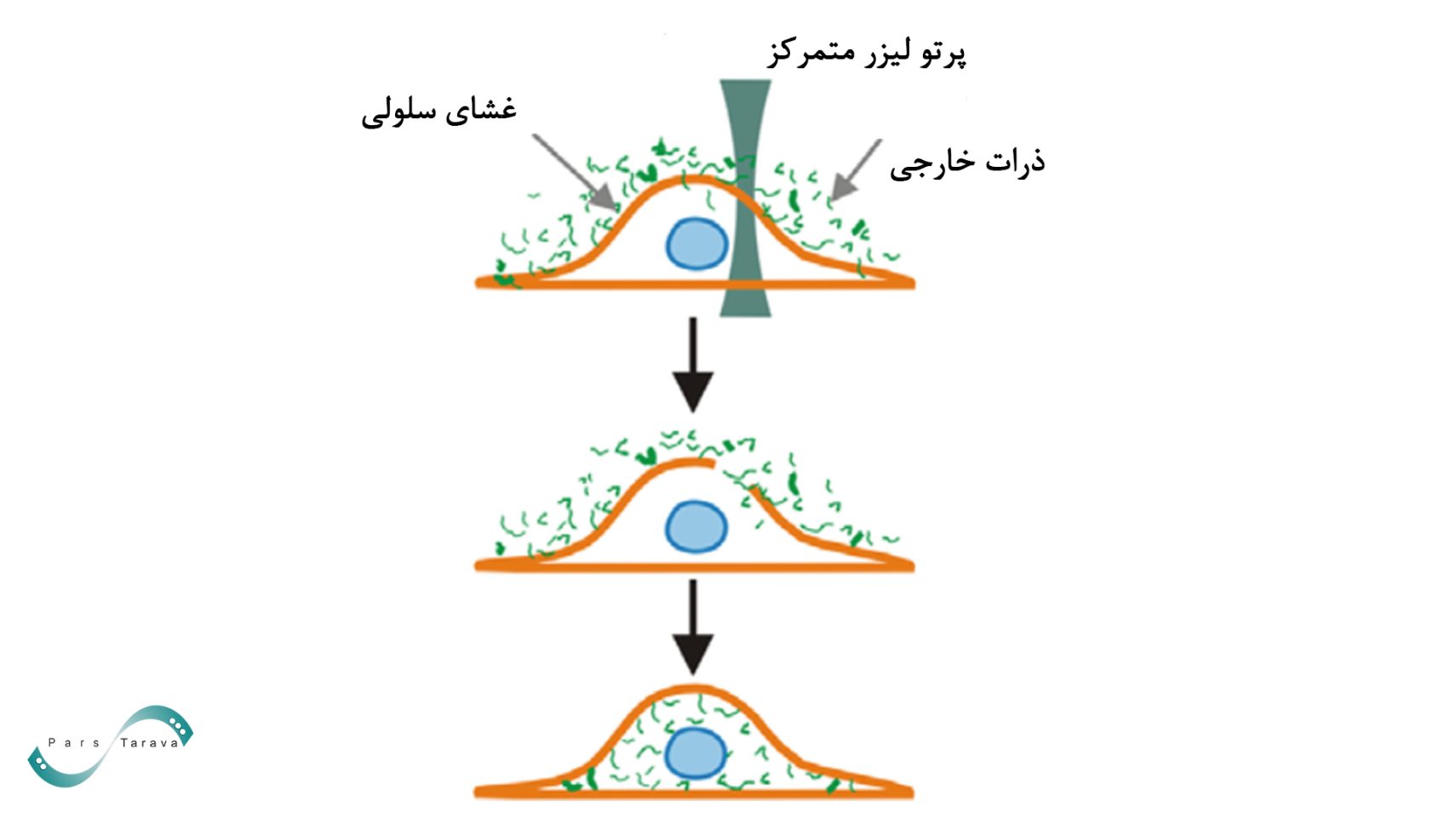
لیزرها برای ورود DNA خارجی به سلولهای کشتشده کارآمد هستند. سلولها پس از تابش لیزر دچار تغییر در نفوذپذیری غشای پلاسمایی میشوند یا در محل تابش منافذی در غشا تشکیل میدهند. همچنین گزارش شده است که حفرهای ایجادشده توسط پرتو لیزر بر روی یک سلول کشتشده، در مدت زمان کوتاهی ترمیم میشود. طولموجهای مختلف برای ایجاد منافذ در غشای پلاسمایی یا تغییر نفوذپذیری آن از طریق اثراتی مانند گرما، جذب، اثرات فتوشیمیایی یا ایجاد گونههای فعال اکسیژن استفاده میشوند.
مزایا:
- تابش لیزر مزیت ترانسفکشن هدفمند را ارائه میدهد که با روشهای شیمیایی یا ویروسی (که تمام سلولهای جمعیت نمونه را تحت تأثیر قرار میدهند) امکانپذیر نیست. در نتیجه، میتوان سلولهای مورد نظر در یک جمعیت مختلط را شناسایی و بهطور انتخابی درمان کرد.
- این روش همچنین امکان نفوذ مستقیم نهتنها به غشای پلاسمایی سلول، بلکه به غشای هسته را فراهم میکند. این ویژگی در ترانسفکشن سلولهای با رشد آهسته، غیرقابل تقسیم یا ردههای سلولی اولیه مانند نورونها اهمیت دارد.
معایب:
- نرخ ترانسفکشن کم است.
- افزایش قابلتوجه میزان مرگومیر سلولی در نتیجه استفاده از پالسهای پرانرژی که ترانسفکشن را افزایش میدهند
- این روش برای استفاده بالینی محدود است، زیرا تمرکز انرژی الکتریکی دشوار و بسیار مخرب است.
.
مگنتوفکشن (Magnetofection)
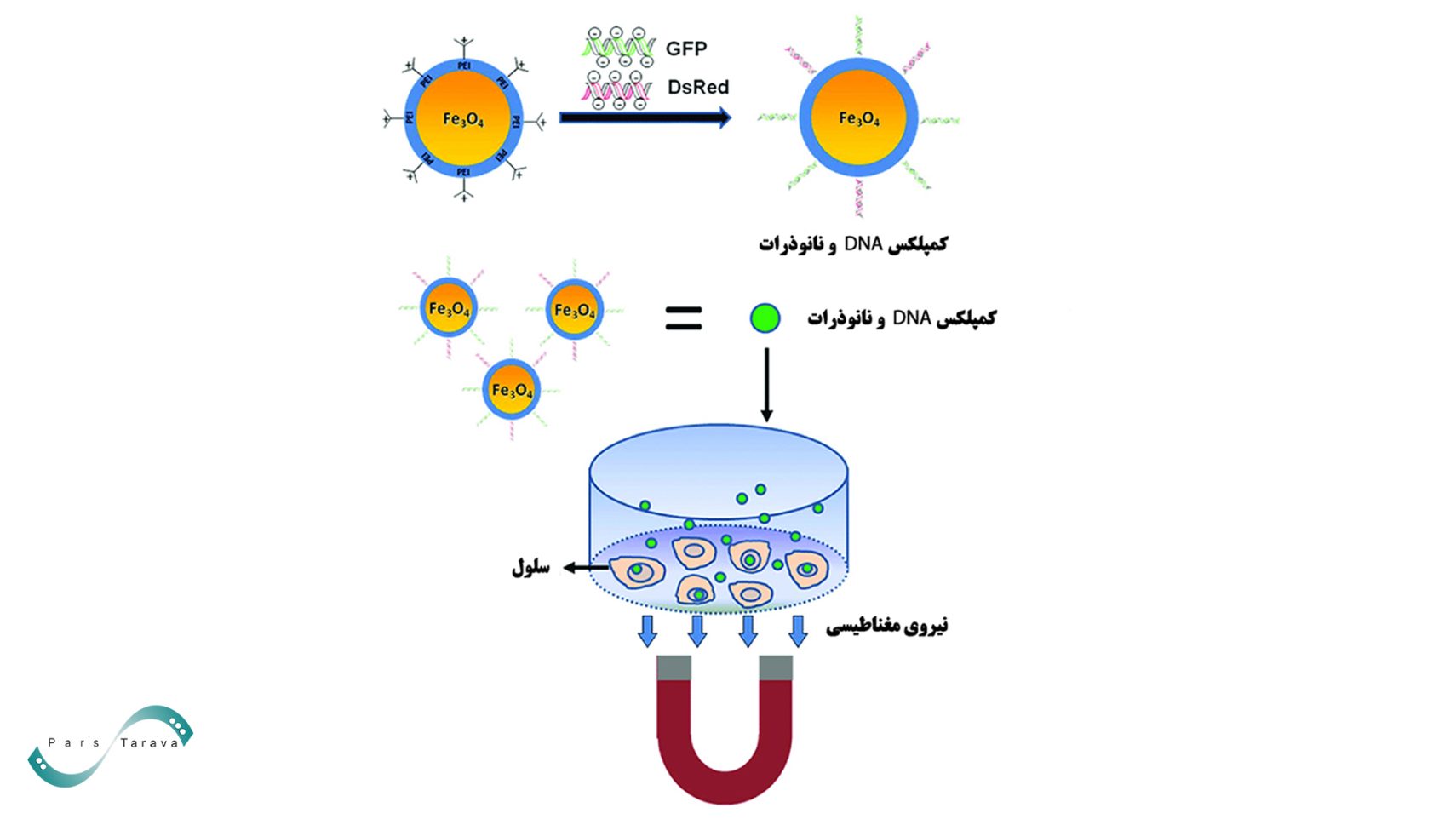
مگنتوفکشن روشی برای ترانسفکشن (انتقال ژن) است که در آن اسیدهای نوکلئیک یا سایر ناقلها با نانوذرات مغناطیسی پوشیدهشده با مولکولهای کاتیونی همراه میشوند. سپس کمپلکسهای مولکولی حاصل به سمت سلولها هدفگیری شده و توسط یک میدان مغناطیسی مناسب پشتیبانی میشوند. نیروی مغناطیسی، انتقال نانوذرات را تسریع کرده و زمانهای فرآیند را کوتاه میکند و در عین حال نرخ انتقال را بهطور قابلتوجهی بهبود میبخشد. ساختار و یکپارچگی غشایی در مقایسه با سایر روشهای فیزیکی انتقال ژن دستنخورده باقی میماند. نانوذرات مغناطیسی از اکسید آهن ساخته میشوند که کاملاً زیستتخریبپذیر بوده و در دوزهای توصیهشده سمی نیست.
مزایا:
- زمان انکوباسیون مورد نیاز برای دستیابی به ترانسفکشن بالا، کوتاه است.
- امکان انتقال ژن به سلولهای غیرمجاز، ترانسفکشن سخت، سلولهای اولیه و سلولهای غیرقابل تقسیم یا تقسیم آهسته وجود دارد.
- روش مقرونبهصرفه است.
ترکیب نانوذرات مغناطیسی با ناقلهای ژنی از هر نوع، منجر به افزایش چشمگیر جذب این ناقلها و راندمان انتقال میشود. این مزایا مگنتوفکشن را به ابزاری ایدهآل برای رویکردهای ژندرمانی ex vivo تبدیل میکند. برای درمانهای مبتنی بر ژن و اسید نوکلئیک in vivo، مگنتوفکشن ممکن است انتخاب مناسبی باشد، بهویژه در مواردی که درمان موضعی مورد نیاز است.
.
هیدروپوریشن
هیدروپوریشن باعث انتقال هیدرودینامیکی DNA میشود. در این روش، منافذ گذرا در غشای سلول باز میشوند که اجازه ورود DNA به سیتوپلاسم را میدهند و معمولاً ظرف ۱۰ دقیقه پس از تزریق بسته میشوند. بازده انتقال ژن در این روش مبتنی بر هیدرودینامیک، با اثر ترکیبی حجم زیاد و سرعت تزریق بالا تعیین میشود.
مزایا: ساده ترین و راحت ترین روش انتقال ژن in vivo است. راندمان هیدروپوراسیون نیز بالاست.
معایب: علاوه بر کبد، کاربرد آن در بافت های دیگر در گذشته به طور کامل بررسی نشده است. اخیراً از هیدروپوریشن در عضله و کلیه نیز استفاده میشود.
رفرنس:
Krut, Z.; Gazit, D.; Gazit, Z.; Pelled, G. Applications of Ultrasound-Mediated Gene Delivery in Regenerative Medicine. Bioengineering 2022, 9, 190. https://doi.org/10.3390/bioengineering9050190








[…] غیر ویروسی متعددی نیز برای انتقال ژن وجود دارد. روش های دیگر انتقال ژن شامل روشهای شیمیایی مانند لیپوفکشن و نانوذرات […]