انتقال ژن با ناقل ویروس
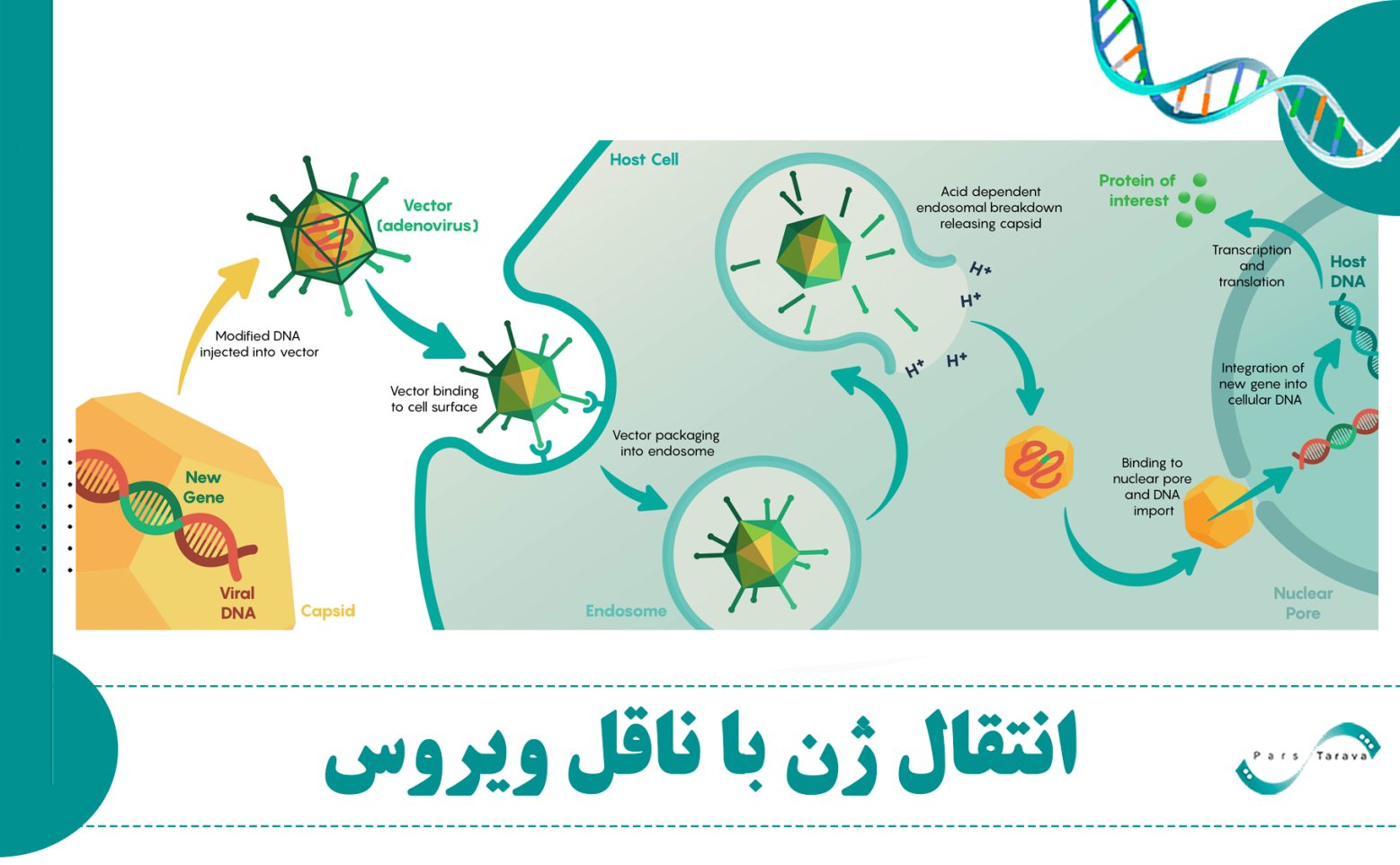
انتقال ژن با ناقل ویروس
انتقال ژن به معنای وارد کردن ماده ژنتیکی به سلول ها برای اهداف مختلف مانند ژن درمانی است است. در این رویکرد، انتقال مؤثر ژن به سلولهای هدف نقش کلیدی دارد. حاملهای ژن (وکتورها) بخش اصلی این روش هستند و شامل دو دسته اصلی ناقلهایویروسی و غیرویروسی میشوند. وکتورهای ویروسی به دلیل بازده بالای انتقال ژن و توانایی ایجاد بیان پایدار ژن در سلولهای هدف، از محبوبیت بالایی برخوردارند. مطالعات بالینی طی دو دهه گذشته نتایج امیدوارکنندهای را نشان دادهاند.
.

یکی از دلایلی که انتقال ژن با ناقلهای ویروسی به عنوان روشی برتر نسبت به استفاده از DNA پلاسمیدی برهنه شناخته میشود، کارایی بالای ورود ژن به سلولهای هدف است. ویروسها طی میلیونها سال تکامل، مکانیسمهای بسیار موثری برای نفوذ به سلولها و تحویل محتوای ژنتیکی خود توسعه دادهاند. بنابراین وقتی از یک ویروس مهندسیشده برای حمل ژن استفاده میشود، این فرآیند بهصورت طبیعی و بسیار مؤثر انجام میشود.
مزیت اصلی این روش در مقایسه با ترانسفکشن با DNA برهنه این است که وکتورهای ویروسی میتوانند ژن را با بازده بالاتر، به طیف وسیعتری از سلولها منتقل کرده و در بسیاری موارد، بیان ژن را برای مدت طولانیتری حفظ کنند. همچنین، انواع مختلف ویروسها برای کاربردهای خاص طراحی شدهاند. به عنوان مثال:
- آدنوویروسها معمولاً برای بیان کوتاهمدت با سطح بالای ژن استفاده میشوند.
- ویروس هرپس سیمپلکس (HSV) به دلیل تمایل طبیعی خود به سلولهای عصبی، برای بیان بلندمدت در سیستم عصبی بسیار مناسب است.
- رتروویروسها و لنتیویروسها این توانایی را دارند که ژن را بهصورت پایدار در ژنوم سلول میزبان ادغام کنند و برای کاربردهایی که به بیان بلندمدت یا دائمی ژن نیاز دارند ایدهآل هستند.
- AAV (ویروس همراه آدنو): برای بیان طولانیمدت بدون ادغام در ژنوم و با کمترین پاسخ ایمنی.
.
ناقلهای ویروسی مختلف برای تحویل ژن
ویروسها برای رساندن نوکلئیک اسیدها به سلولها تکامل یافتهاند. ویروسهای پوششدار و بدون پوشش روشهای متفاوتی را برای تعامل با غشا دنبال میکنند. در مورد ویروسهای پوششی، آنها با اتصال به گیرندههای خاص در سطح سلول و سپس با همجوشی مستقیم با غشای پلاسمایی یا پس از جذب توسط اندوسیتوز، با متصل شدن به غشای اندوزومی ژن را انتقال میدهند.
اما، ویروسهای بدون پوشش با پروتئینهای ویریون خاص به پلاسما یا غشای اندوزومی نفوذ کرده یا آنها را مختل میکنند. در هر مورد، ژنوم ویروس در سیتوپلاسم بدون پوشش قرار میگیرد و به محل تکثیر طبیعی خود که ممکن است هسته باشد یا نباشد منتقل میشود.
انواع ناقل های ویروسی عبارتند از:
.
آدنوویروسها
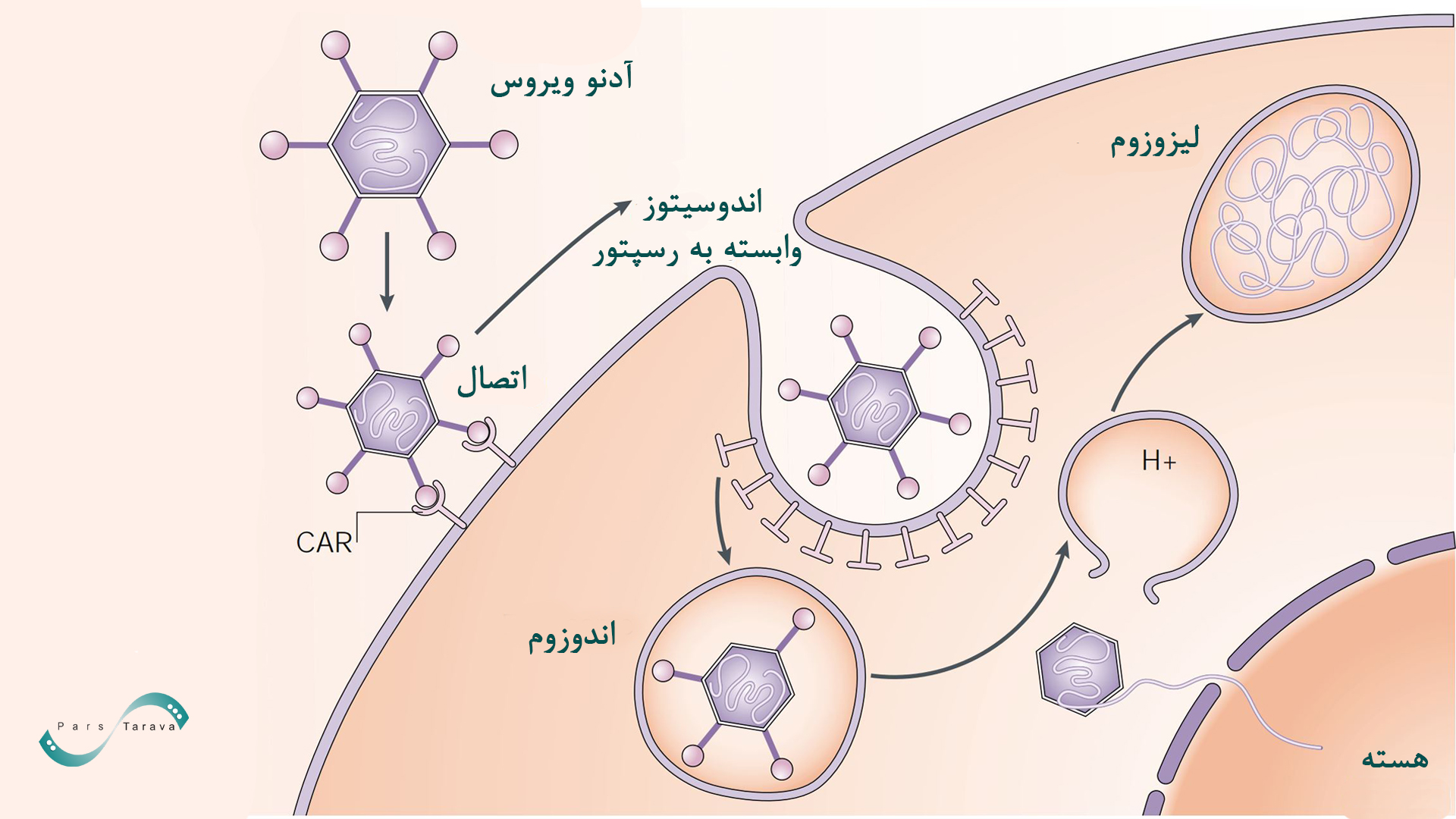
این گروه از وکتورها فاقد پوشش پروتئینی هستند و ژنومی دو رشتهای به طول حدود ۲۶–۴۵ کیلوباز دارند. وکتورهای آدنوویروس به دلیل توانایی انتقال ژن به انواع بافتها و کارایی بالای ورود به سلول، گزینهای محبوب برای انتقال ژن هستند. آدنوویروسها میتوانند سلولهای تقسیمشده و غیرتقسیمشده را آلوده کنند که این قابلیت بازده انتقال ژن را بهطور چشمگیری افزایش میدهد. با این حال، این ناقلها واکنش ایمنی شدید در میزبان ایجاد میکنند.
شش زیر گروه از آدنوویروسهای انسانی بر اساس سنجش آگلوتیناسیون سلولی و محتوای GC ژنومی تعریف شدهاند. مزایای عمده وکتورهای آدنوویروسی این است که میتوان آنها را تا تیترهای بسیار بالا خالص کرد، که برای کاربردهای in vivo آنها را مناسب میکند و اگر سلولهای هدف گیرندههای مناسب را داشته باشند، کارایی انتقال ژن به 100٪ نزدیک میشود.
در نسل سوم وکتورهای آدنو (HC-Ad یا gutless adenovirus)، تمامی ژنهای ویروسی حذف شده و تنها عناصر ITR باقی میماند. این وکتورها توانایی حمل بارهای ژنی بسیار بزرگ (حدود ۳۶ کیلوباز) را دارند.
.
ویروس هرپس سیمپلکس (Herpes Simplex Virus)
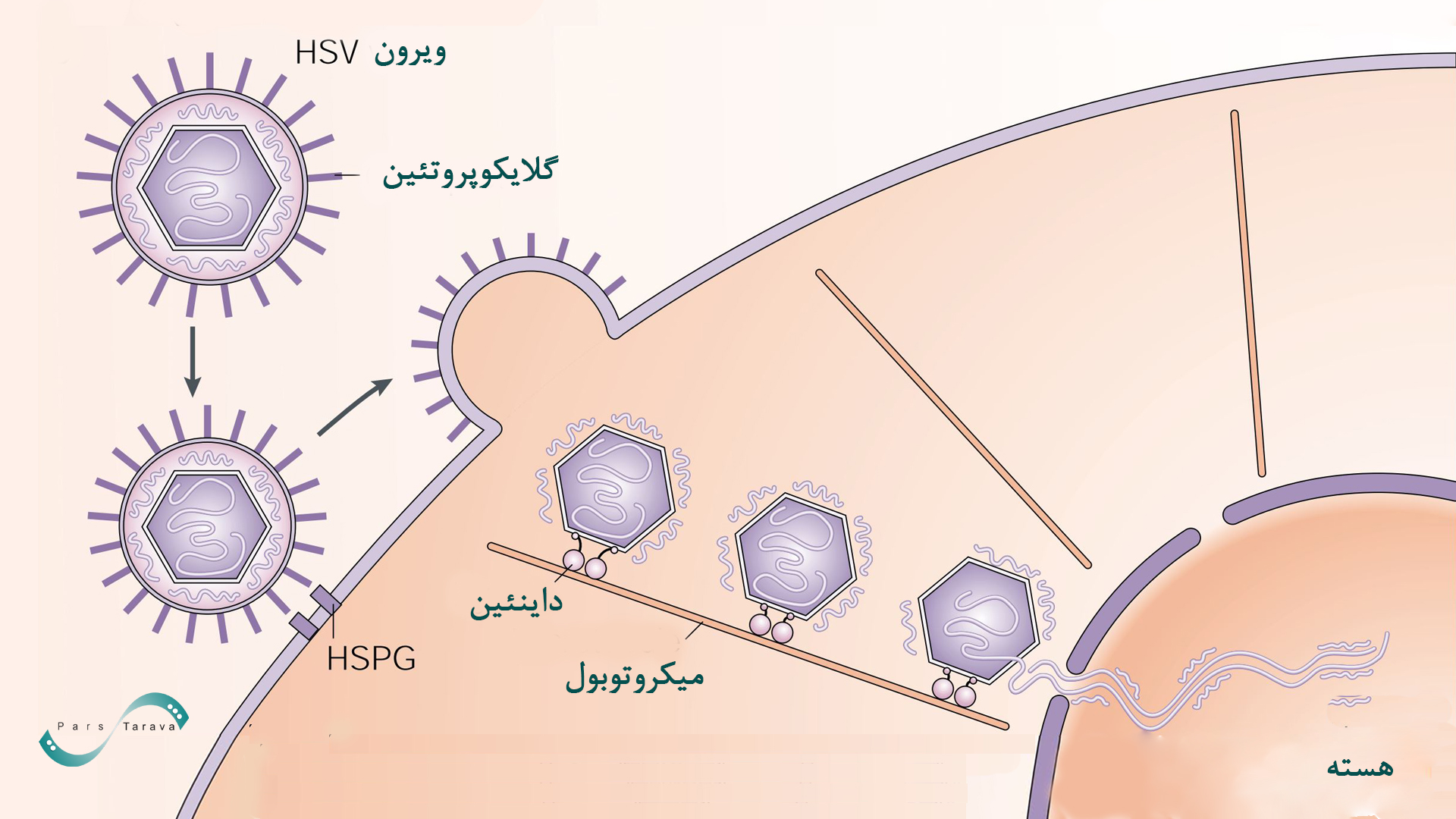
ویروس هرپس (HSV) یکی دیگر از ناقلهای ویروسی است که دارای ژنوم DNA دو رشتهای بسیار بزرگ (حدود ۱۵۲ کیلوباز) میباشد. ساختار ویریون شامل یک پوشش لیپیدی بیرونی است که با تعداد زیادی گلیکوپروتئین و سایر پروتئینها پوشانده شده است و ماتریکسی از پروتئینها به نام تگمنت را احاطه کرده است که روی کپسید مناسب قرار دارد.
این ویژگیها به آن اجازه میدهد تا ژنهای بسیار بزرگ یا چندین ژن را بهطور همزمان حمل کند و تنوع قابلتوجهی در محدوده میزبان و تمایل سلولی خود نشان میدهد. ویروس هرپس که به عنوان ناقل استفاده میشوند، ویروس اپشتین بار (EBV) و ویروس هرپس سیمپلکس (HSV1) هستند. HSV1 دارای دامنه میزبان و تمایل سلولی بسیار وسیع است و به یک وکتور انتقال همه کاره تبدیل شده است.
HSV بهویژه برای هدفگیری سلولهای عصبی بسیار مناسب است و در درمان بیماریهای عصبی مانند پارکینسون، آلزایمر و دردهای مزمن کاربرد بالقوه دارد. نسخههای نوترکیب HSV به گونهای طراحی شدهاند که فاقد ژنهای بیماریزا باشند و فقط بهعنوان حامل ژن عمل کنند. چالش اصلی این ناقل، تحریک سیستم ایمنی و پیچیدگی زیاد در مهندسی آن است.
.
رتروویروسها (Retrovirus)
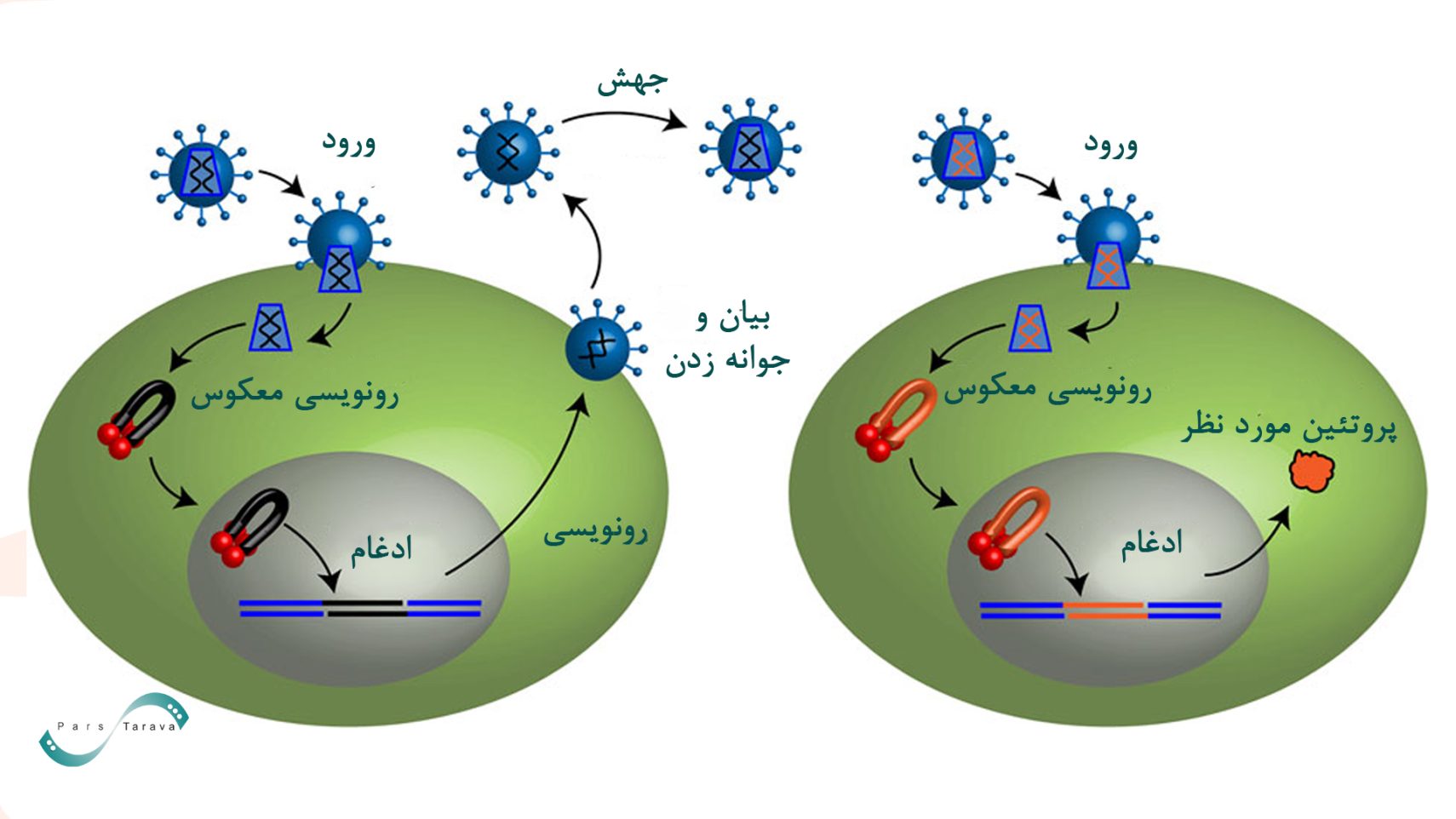
رتروویروسها (Retrovirus) ویروسهای RNA و پوششی دار هستند که از یک ویریون پروتئینی با قطر تقریباً 100 نانومتر تشکیل شدهاند که توسط دولایه لیپیدی احاطه شده است. این ویروسها تکریشهای (Retroviridae) بوده و RNA تکرشتهای دارند که آنزیم ترانسکریپتاز معکوس را حمل میکنند. پس از ورود به سلول هدف، این آنزیم RNA را به DNA تبدیل میکند و ژن منتقلشده را در ژنوم میزبان ادغام مینماید.
هفت جنس از رتروویروسها بر اساس دادههای مقایسه توالی وجود دارد. آنکورتروویروسهای معمولی، مانند ویروس لوسمی موشی (MLV) ساده هستند. در حالی که لنتی ویروسها مانند ویروس نقص ایمنی انسانی (HIV) و اسپوماویروسها پیچیده هستند.
.
لنتیویروسها (Lentivirus)
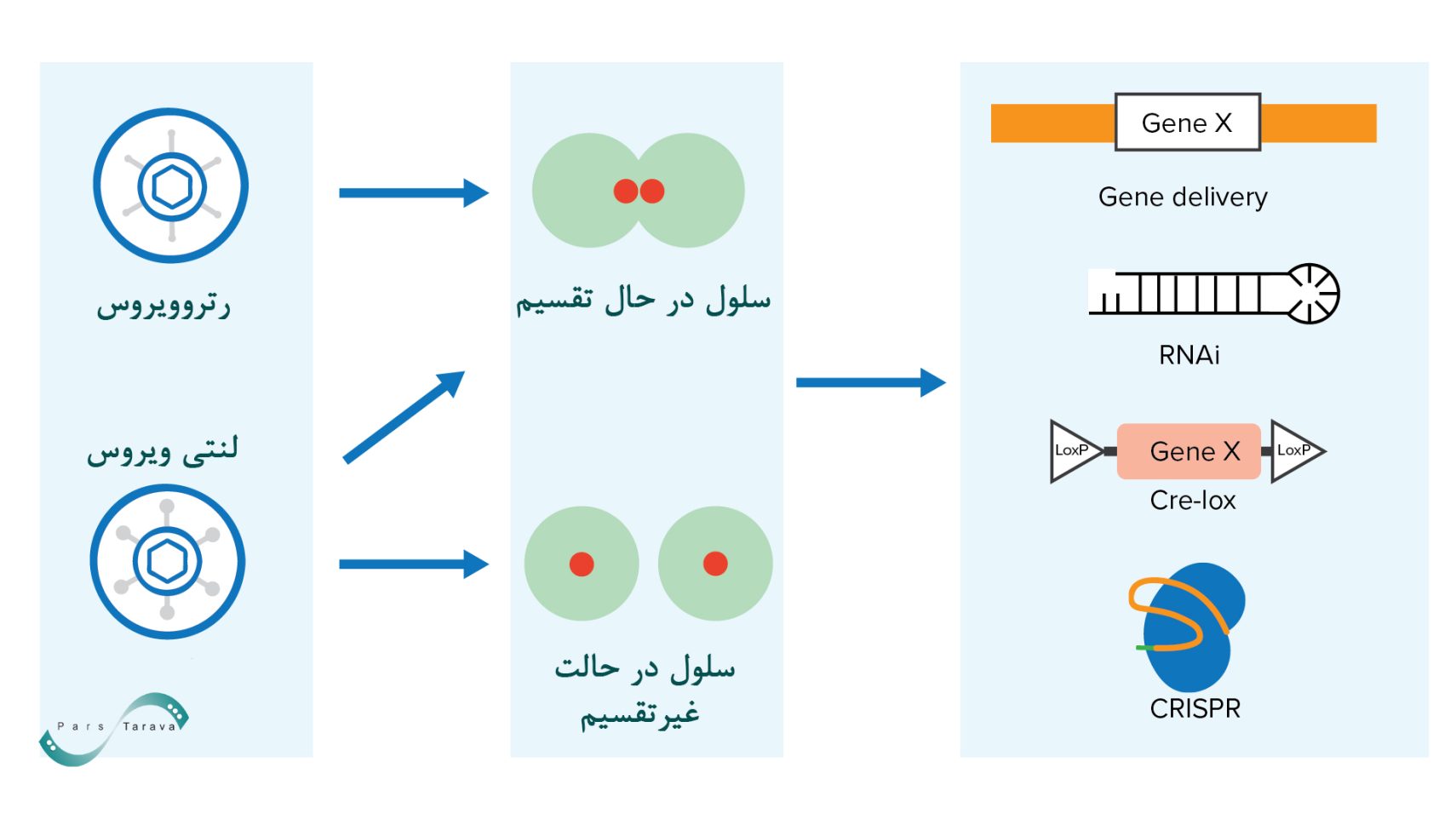
وکتورهای لنتیویروس (مانند نسخه اصلاحشده HIV) این توانایی را دارند که حتی در سلولهای غیرتکثیرشونده نیز وارد هسته شده و بیان بلندمدت ژن را برقرار کنند. برای مثال، این وکتورها میتوانند ژن را برای مدت طولانی در سلولهای تقسیمنشده حفظ کنند.
استراتژی تکثیر رتروویروسها منحصر به فرد است. پس از ورود به سلول، ویروس بدون پوشش میشود و RNA ژنومی به هسته منتقل میشود و در آنجا به یک کپی cDNA دو رشتهای توسط پروتئین ویریون رونوشت معکوس تبدیل میشود. سپس یک پروتئین ویریون دوم، اینتگراز، این کپی cDNA را وارد ژنوم میزبان میکند. ظرفیت انتقال لنتیویروسها حدود ۸–۹ کیلوباز است که نسبتاً بیشتر از وکتورهای AAV است. با وجود این مزایا، عدم کنترل دقیق محل ادغام ژن در ژنوم میزبان ممکن است منجر به خطر جهشهای ناخواسته شود.
رتروویروسها ناقلهای سودمندی هستند که توانایی تولید تیترهای ویروسی بالا (106-108 ذره در میلیلیتر) را با استفاده از خطوط بستهبندی در دسترس دارند، کارایی باورنکردنی انتقال پایدار (نزدیک به 100٪ در شرایط آزمایشگاهی، اما همچنین بسیار بالا در داخل بدن) و توانایی شبهسازی ذرات ویروسی را دارند. ژنوم ویروسی کوچک پس از تبدیل شدن به یک کپی cDNA در آزمایشگاه به راحتی قابل دستکاری است و دارای یک سیستم پروموتر/ تقویت کننده مفید است که میتواند برای تحریک بیان تراریخته استفاده شود.
.
ویروس همراه آدنو (Adeno-Associated Virus)
آدنو ویروس (AAV) این وکتور یک ویروس کوچک بدون پوشش است که به تنهایی توان تکثیر ندارد (برای تکثیر به ویروس کمکی نیاز دارد). وکتورهای AAV به دلیل ایمنی بالای استفاده و پایداری بیان ژن در بافتهای مختلف، گزینهٔ ایدهآلی برای انتقال ژنهای درمانی بلندمدت هستند. معمولاً ژن انتقالی در این وکتورها بهصورت اپیکروماتیک در هسته سلول باقی میماند و بیان طولانیمدتی را ارائه میکند. همچنین AAVها واکنش ایمنی بسیار کمتری نسبت به آدنوویروسها ایجاد میکنند که مزیتی مهم در کاربرد بالینی محسوب میشود. نقطه ضعف اصلی AAV، ظرفیت کوچک ژنومی آن (~۴–۵ کیلوباز) است که بسیاری از ژنهای بزرگ را خارج از محدوده حمل آن قرار میدهد.
.
مزایا و چالشهای انتقال ژن با ناقل ویروسی
انتقال ژن با ناقلهای ویروسی دارای مزایای قابل توجهی است. مهمترین مزیت آنها بازده بسیار بالای وارد کردن ژن به سلولهای هدف و ایجاد بیان بلندمدت ژن در آنهاست. این وکتورها از مکانیسم طبیعی ویروسها برای ورود به سلول استفاده میکنند و با مهندسی ژنتیکی ویژهای که روی آنها صورت گرفته، ژنهای بیماریزا از آنها حذف شده است. به این ترتیب میتوان از مزایای ذاتی انتقال ویروسی بهره برد بدون اینکه ویروس قادر به تکثیر و ایجاد عفونت باشد.
از سوی دیگر، چالشهای عمده این روش شامل تحریک سیستم ایمنی میزبان و محدودیت ظرفیت است. واکنش ایمنی قوی بدن به پروتئینهای ویروس میتواند کارایی درمان را کاهش داده و خطر عوارض جانبی را افزایش دهد. علاوه بر این، ظرفیت محدود برخی وکتورها (بهویژه AAV) و احتمال ادغام تصادفی DNA وکتوری در ژنوم میزبان (بهویژه در رتروویروسها) نیز چالشهایی مهم هستند.
.
سایر روشهای انتقال ژن
علاوه بر وکتورهای ویروسی، روشهای غیر ویروسی متعددی نیز برای انتقال ژن وجود دارد. روش های دیگر انتقال ژن شامل روشهای شیمیایی مانند لیپوفکشن و نانوذرات کاتیونی میتوانند DNA یا RNA را به سلولهای هدف منتقل کنند. روشهای فیزیکی مانند میکرواینجکشن (تزریق مستقیم ژن به داخل هسته سلول) و تفنگ ژنی (شلیک ذرات کوچک حامل ژن به بافتهای سلولی) نیز در شرایط آزمایشگاهی استفاده میشوند. همچنین، فناوریهای پیشرفتهای مانند CRISPR/Cas9 به عنوان ابزارهای ویرایش ژن بدون نیاز به ناقل ویروسی عمل میکنند. با این حال، بازده روشهای غیر ویروسی اغلب کمتر از ناقلهای ویروسی است، هرچند ریسک ایمنی آنها پایینتر است.
.
الکتروپوریشن: جایگزین غیرویروسی کارآمد
الکتروپوریشن یکی از روشهای غیرویروسی مؤثر برای انتقال ژن است. در این روش، پالسهای الکتریکی کوتاه و قوی به سلول اعمال میشود تا منافذ موقتی در غشای سلول ایجاد شده و مولکولهای DNA یا RNA وارد داخل سلول شوند. الکتروپوریشن بهدلیل سادگی فرآیند و بازده نسبتاً بالا در انتقال، در بسیاری از مطالعات زیستی کاربرد دارد.
مزیت دیگر این روش این است که DNA بهطور مستقیم وارد سیتوپلاسم میشود و در اندوزومها تخریب نمیگردد. در نتیجه، مقدار بیشتری از DNA منتقلشده به هسته سلول میرسد و احتمالا اثربخشی انتقال افزایش مییابد. شرکت پارس تراوا در ایران تولیدکننده تجهیزات الکتروپوریشن است و اولین شرکتی است که دستگاه الکتروپوریشن را به صورت تجاری در کشور تولید کرده است. برای اطلاعات بیشتر میتوانید با شمارهتلفن و واتسآپ ۰۹۰۲۴۰۵۱۸۶۲ تماس بگیرید.
.
کاربردهای بالینی انتقال ژن با ناقلهای ویروسی
کاربرد ناقلهای ویروسی در درمانهای بالینی، یکی از پیشرفتهترین و امیدوارکنندهترین حوزههای زیستفناوری پزشکی محسوب میشود. این وکتورها امکان انتقال پایدار ژنهای درمانی به سلولهای انسانی را فراهم میکنند و در سالهای اخیر، چندین محصول درمانی موفق و تایید شده بر پایهٔ آنها توسعه یافتهاند. در ادامه، نمونههایی از مهمترین کاربردهای بالینی انتقال ژن با استفاده از ناقلهای ویروسی معرفی شدهاند که تأییدیههای بینالمللی گرفتهاند و در حال حاضر در درمان بیماران مورد استفاده قرار میگیرند:
- لوکسترنا (Luxturna): دارویی بر پایه وکتور AAV2 حامل نسخه سالم ژن RPE65 برای درمان نابینایی ارثی (Leber congenital amaurosis).
- ایمنیدرمانی CAR-T (کایمریا و یسکارته): درمان سرطان بر پایه اصلاح ژن سلولهای T با وکتور لنتیویروس برای بیماران مبتلا به انواع لوسمی و لنفوم.
- Zolgensma: وکتور AAV9 حامل ژن SMN1 برای درمان آتروفی عضلانی نخاعی در نوزادان (SMA).
- Zynteglo: وکتور لنتیویروس حامل ژن HBB برای درمان کمخونی داسی (بتا تالاسمی)، مورد تأیید اتحادیه اروپا.
- Strimvelis: وکتور رتروویروس برای درمان نقص ایمنی شدید (ADA-SCID)، مورد تأیید اروپا.
- کایمریا (Kymriah): وکتور لنتیویروس برای اصلاح ژن سلولهای T بیماران لوسمی، نخستین درمان CAR-T تأیید شده توسط FDA.
.
در انتها
انتقال ژن با ناقلویروسی یک ابزار قدرتمند برای درمان بیماریهای ژنتیکی به شمار میآید. این روش مزایایی چون کارایی بسیار بالا در انتقال ژن و بیان بلندمدت ژن منتقلشده را فراهم میکند، اما در عین حال چالشهایی مانند واکنش ایمنی میزبان و محدودیت ظرفیت را نیز دارد. به همین دلیل، ترکیب روشهای ویروسی و غیرویروسی (مانند الکتروپوریشن) راهکاری مطلوب برای بهبود کارایی و ایمنی انتقال ژن در نظر گرفته میشود. با ادامه پیشرفتهای فنی و همکاریهای میانرشتهای، انتظار میرود فرصتهای درمانی جدیدتری در حوزه ژندرمانی پدید آید. انتقال ژن با ناقلویروسی هنوز در حال تکامل است و با هر موفقیت جدید در بهبود ایمنی و اثربخشی، مسیر برای درمانهای نوین هموارتر میشود.
.
اگر علاقهمند به دریافت اطلاعات بیشتر، مشاوره یا تهیه تجهیزات پیشرفته الکتروپوریشن هستید، تیم متخصص ما در پارس تراوا با افتخار پاسخگوی شماست. از طریق تماس تلفنی یا پیام در واتساپ با شماره ۰۹۰۲۴۰۵۱۸۶۲ میتوانید بهراحتی با ما در ارتباط باشید.
مطالعه مقانتقال ژن به روش غیرویروسی فیزیکی
شرکت پارستراوا اولین و تنها تولید کننده دستگاه الکتروپوریشن (الکتروپوراسیون) و کووت الکتروپوریشن میباشد. برای کسب اطلاعات بیشتر درمورد محصولات و خدمات شرکت با شماره ۰۹۰۲۴۰۵۱۸۶۲ تماس بگیرید.
.
رفرنس:
Viral vector platforms within the gene therapy landscape
Viral Vector-Based Gene Therapy
Recent progress in viral and non-viral therapy.” Recent advances in novel drug carrier systems
Viral vectors for gene delivery to the nervous system
Strategies for Targeting Retroviral Integration for Safer Gene Therapy: Advances and Challenges.
Targeting microglia with lentivirus and AAV: Recent advances and remaining challenges
.







