الکتروپوریشن برگشتناپذیر (IRE): فناوری نوین برای از بین بردن تومورهای سرطانی


الکتروپوریشن برگشتناپذیر (Irreversible Electroporation) یک روش تخریب توموری جدید و غیرحرارتی است که به جای گرما، با اعمال پالسهای کوتاهمدت الکتریکی و با ولتاژ بالا سبب ایجاد تخلخل دائمی در غشای سلولی میشود و در نهایت مرگ سلولی را القا میکند. بر خلاف روشهای تخریبی حرارتی (مانند RF یا مایکروویو) که منجر به نکروز حرارتی ساختارهای اطراف تومور میشوند، IRE به بافت همبند و عناصر غیرسلولی (مثل کلاژن و رشتههای الاستیک عروق و اعصاب) آسیب نمیزند. این ویژگی امکان درمان تومورهایی را فراهم میکند که در مجاورت ساختارهای حساس آناتومیک (رگهای بزرگ، مجاری صفراوی، اعصاب) قرار دارند. همچنین IRE برخلاف روشهای دارودرمانی نیاز به آنتیبیوتیک یا ماده شیمیایی خاص ندارد و تنها با انرژی الکتریکی سلولهای هدف را تخریب میکند.
روش درمان الکتروپورشین بستگی به عوامل مختلفی دارد. ولتاژ اعمال شده، مدت زمان ولتاژ و تعداد آن و ترخ تکرار پالس و همچنین فاصله بین تومور مورد نظر و الکترود. هماهنگی درمان انجام شده در
مکانیسم اثر الکتروپوریشن برگشت ناپذیر
در IRE، اعمال میدان الکتریکی زیاد بهصورت پالسهای میکروثانیهای باعث ایجاد تخلخل (حفره) در غشای سلولی میشود. اگر شدت میدان از یک آستانه خاص فراتر رود، سلول قادر به ترمیم تخلخل نیست و تعادل اسمزیاش از بین میرود؛ در نتیجه مرگ سلولی رخ داده و سلول میمیرد. این مرگ سلولی عمدتاً به شکل آپوپتوز به وقوع میپیوندد و تحریک سیستم ایمنی نیز مشاهده شده است. از جمله شرایط مهم در اثر IRE مقدار ولتاژ، تعداد پالسها و نرخ تکرار آن، فاصله الکترودها و هدایت الکتریکی بافت هدف است. بهینهسازی این پارامترها برای ایجاد ناحیه تخریب مؤثر ضروری است.
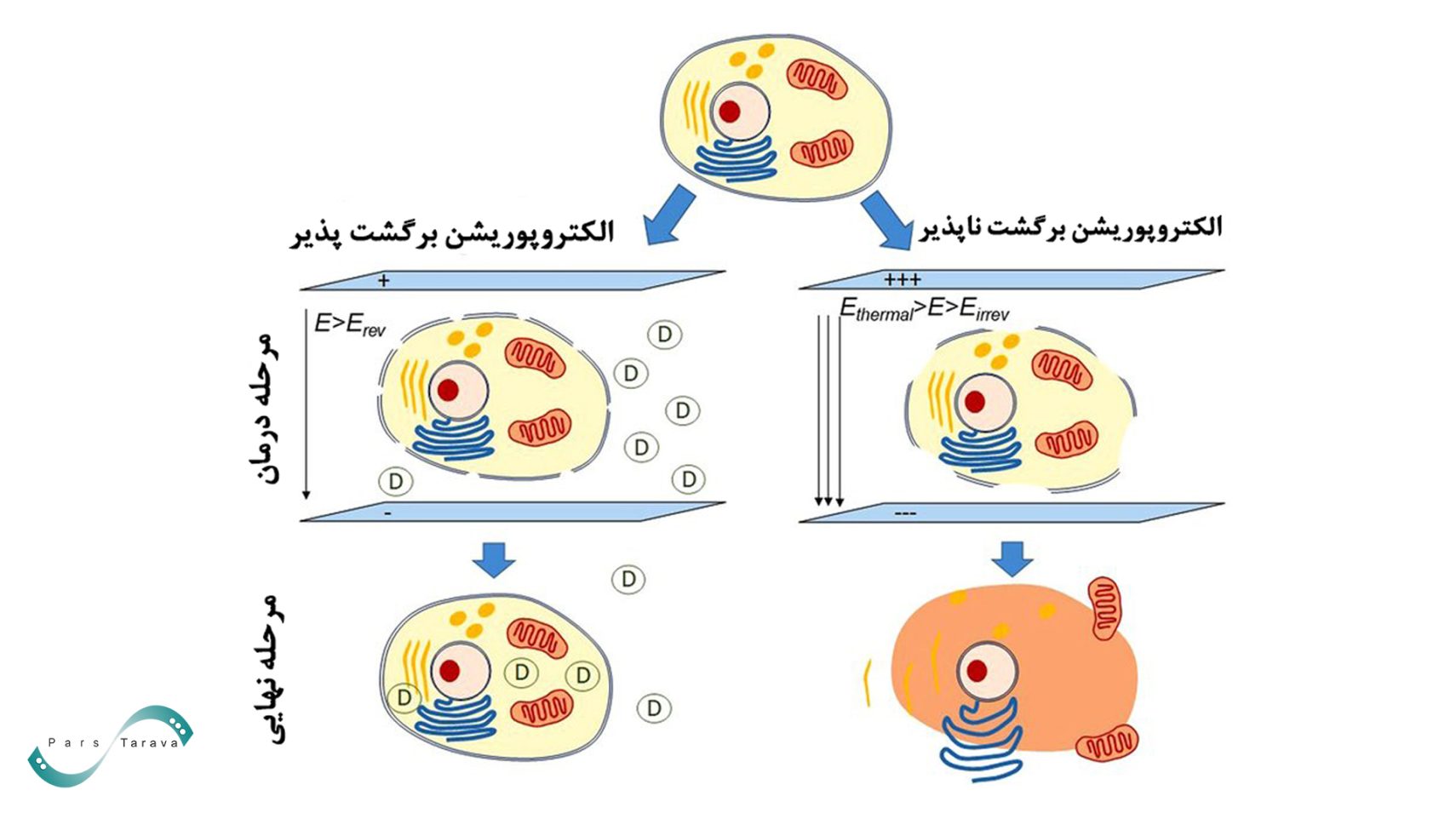
تفاوت الکتروپوریشن برگشت ناپذیر و برگشت پذیر

الکتروپوریشن بهطور کلی روشی است که در آن پالسهای الکتریکی باعث ایجاد منافذ موقت یا دائم در غشای سلول میشوند. اگر شدت میدان الکتریکی پایین باشد، غشاء سلولی میتواند خود را ترمیم کرده و این حالت الکتروپوریشن برگشتپذیر (Reversible Electroporation) نامیده میشود. از این حالت بیشتر در زمینههایی مانند انتقال ژن، دارورسانی هدفمند یا الکتروشیمیدرمانی استفاده میشود. اما اگر شدت میدان از آستانه مشخصی بیشتر شود، سلول دیگر توانایی ترمیم غشاء را ندارد و در نتیجه دچار مرگ سلولی میشود؛ این حالت الکتروپوریشن برگشتناپذیر (Irreversible Electroporation) است. IRE عمدتاً در درمان تومورهای جامد کاربرد دارد و برخلاف نوع برگشتپذیر، نیاز به مواد شیمیایی مکمل ندارد بلکه به تنهایی باعث مرگ و نابودی سلول هدف میشود.
کاربردهای بالینی

IRE در درمان تومورهای جامد متعددی به کار برده شده است که مهمترین آنها شامل کبد، پانکراس و پروستات میشود.
تومورهای کبدی (HCC و متاستازهای کبد):
IRE گزینه مناسبی برای تومورهای کبدی است که در مجاورت عروق بزرگ (مانند ورید پورت یا ورید اجوف) یا مجاری صفراوی قرار دارند و از طریق روشهای حرارتی قابل درمان نیستند. مطالعات نشان دادهاند که IRE در این بیماران میتواند بدون آسیب به ساختار عروق و مجاری، مرز دقیق تخریب را ایجاد کند . بازنگریهای سیستمایتیک نشان داده نرخ عارضه بعد از IRE در کبد در حد ۱۶٪ است که عمدتاً عوارض خفیف (مرتبط با کارگذاری پروب) بوده است. در مطالعات انجام شده گزارش کردند که از بین ۱۵۸ رگ مجاور تومور، تنها در ۴.۴٪ موارد تغییرات خفیف عروقی مشاهده شد. علاوه بر این، IRE میتواند تومورهای کبد تا قطر چند سانتیمتر را بهخوبی درمان کند؛ بهطوری که مهمترین اقدامات بالینی روی تومورهای معمولاً ۲–۳ سانتیمتری متمرکز بوده است.
تومورهای پانکراس:
در سرطان پانکراس پیشرفته، تومورها اغلب در تماس با عروق اصلی میباشند و درمان جراحی یا حرارتی دشوار است. به دلیل ماهیت غیرحرارتی IRE و حفظ عملکرد عروق، این روش برای تومورهای پانکراس پیشرفته مطرح شده است. IRE امکان تخریب سلولهای توموری در کنار عروق بدون ایجاد ایسکمی عروقی را فراهم میکند، بنابراین حتی در موارد پیشرفته نیز بهعنوان تکمیلکننده شیمیدرمانی قابل استفاده است. مطالعات مقدماتی نشان دادهاند که ایمنی و اثربخشی IRE در درمان پانکراس قابل قبول است، اگرچه این روش عمدتاً در حال حاضر بهصورت مطالعات تحقیقاتی و یا بهعنوان درمان تسکینی (palliative) استفاده میشود.
تومورهای پروستات:
یکی از جذابیتهای IRE در سرطان پروستات، حفظ عصبها و عملکرد ارگان است. IRE باعث آسیب به لایههای مخاطی میشود اما ساختار پروستات را نسبیاً حفظ میکند و عوارض جنبی مانند ناتوانی جنسی و ادراری پس از درمان را کاهش میدهد. این روش ابتدا در مطالعات حیوانی و سپس در کارآزماییهای بالینی محدود در سرطان پروستات بررسی شد. نتایج اولیه در سگها و انسان، نشاندهنده تحمل بالای درمان و تخریب سلولی مناسب در ناحیه تومور بوده است؛ برای نمونه، در مطالعهای که در آن IRE روی پروستات 6 سگ مذکر انجام شد، در هیچ مورد مرگ یا عارضه جدی بعد از عمل گزارش نشده است. در مطالعات بالینی انسانی نیز نتایج نویدبخشی در تخریب تومورهای کوچک پروستات و حفظ عملکرد نعوظ و کنترل ادرار گزارش شده است.
سایر کاربردها:
علاوه بر اندامهای فوق، IRE در سایر تومورهای جامد (کلیه، مغز، پستان و بافت نرم) نیز در مطالعات محدود بررسی شده است. بهعنوان مثال، میتوان به مطالعات حیوانی در تومورهای ریوی اشاره کرد که نشان داد هرچند ریه بهخاطر بافت خاص آن، چالشبرانگیز است، در سایر بافتها (مثل کلیه) میتوان نواحی بزرگتر تخریب با کمترین عارضه ایجاد کرد.
انتخاب بیمار و مراحل درمان
انتخاب بیمار مناسب و آمادهسازی او قبل از درمان اهمیت بالایی دارد. معمولاً بیماران توسط تیمی متشکل از چندین پزشک متخصص (MDT) بررسی میشوند. معیارهای عمومی انتخاب بیمار شامل وضعیت فیزیکی مطلوب (بهعنوان مثال نمره ECOG ≤2) و نداشتن متاستاز پیشرفته است.
از نظر آناتومیک، IRE بیشتر برای تومورهای لوکال پیشرفته انتخاب میشود که در نزدیکی ساختارهای حیاتی قرار داشته و سایر روشها کارآمد نبودهاند. همچنین بررسی سابقه قلبی برای هماهنگسازی پالسها ضروری است؛ به عنوان مثال، سابقه آریتمی جدی قلبی یا استفاده از پیسمیکر از موارد عدم صلاحیت محسوب میشوند.
برای تعیین مناسب بودن درمان برای بیمار، معاینه تصویربرداری (CT/MRI) از تمامی ابعاد تومور و ارگانهای مجاور انجام شده و مشاوره بیهوشی برای اطمینان از امکان بیهوشی عمومی و بلوک عضلانی لازم است.
مراحل انجام درمان:
- بیهوشی عمومی با بلوک عضلانی کامل: جهت جلوگیری از انقباضات عضلانی ناشی از پالسها، بیهوشی عمومی و فلج کامل عضلات ضروری است.
- همگامسازی با ضربان قلب: در مواردی که تومور در نزدیکی قلب قرار ندارد معمولاً از دستگاه گیتینگ استفاده میشود تا پالسها هنگام دوره غیرتحریکپذیری قلب (بین دو موج R) اعمال شوند و خطر آریتمی کاهش یابد. چهار بیمار اولی که تحت درمان IRE بدون گیتینگ قرار گرفتند دارای آریتمی گذرا شدند و پس از آن گیتینگ قلبی به استاندارد دستگاه افزوده شد.
- هدایت تصویری الکترودها: معمولاً ۲ تا ۶ الکترود مونوپلار نوکتیز تحت هدایت سونوگرافی، سیتی اسکن یا هر دو، بهگونهای در اطراف تومور هدایت و قرار داده میشوند که سراسر حجم هدف را پوشش دهند. فاصله بین الکترودها معمولاً حدود ۱.۵–۲ سانتیمتر تنظیم میشود و آرایش مثلثی یا مسطح متناسب با شکل تومور انتخاب میشود. رعایت موازی بودن الکترودها (زاویه کمتر از ~۱۰ درجه) و قرارگیری نوکهای الکترود در یک صفحه نیز برای ایجاد منطقه تخریب یکنواخت ضروری است.
- ارسال پالسهای الکتریکی: ابتدا به ازای هر جفت الکترود چند پالس آزمایشی (حدود ۱۰ پالس) با شدت جریان هدف ۲۰–۵۰ آمپر داده میشود تا پاسخ بافت سنجیده شود. سپس حدود ۷۰ پالس نهایی (هر کدام ۷۰–۹۰ میکروثانیه) با افزایش مرحلهای جریان (هر بار حدود ۱۲–۱۵ آمپر بیش از پالس قبلی) اعمال میشوند. این پالسها بین الکترودهای همجوار اعمال شده و مجموعاً کل ناحیه تومور را دچار الکتروپوراسیون میکنند.
- بررسی و تعیین حجم ناحیه تخریب: در حین یا بلافاصله پس از IRE، ممکن است تصویربرداری (CT یا سونوگرافی) انجام شود تا ناحیههای هایپو اکو یا گازی ناشی از الکترولیز آب (نشانه تخریب) ارزیابی شود. در صورت نیاز، الکترودها جاگذاری مجدد شده یا موقعیت شلیک مجدد پالسها تغییر میکند.
- مراقبت پس از عمل: پس از خاتمه IRE، تمرکز بر کنترل درد و پایش علائم حیاتی و عملکرد ارگان مربوطه است. معمولاً افزایش موقت آنزیمهای کبدی (AST و ALT) و بیلیروبین در ۲۴ ساعت پس از عمل دیده میشود که بهصورت خودبهخودی طی چند هفته بهبود مییابد. توصیه میشود بیماران تحت مراقبت قرار گرفته و خروج کلیه مقادیر خون و بیوشیمی طی دوره نقاهت کنترل شود.
ایمنی و عوارض الکتروپوریشن برگشت ناپذیر
ایمنی IRE تا حد زیادی به حفظ ساختارهای عروقی و عصبی اطراف تومور وابسته است. مهمترین مزیت IRE این است که امکان درمان تومورهایی را فراهم میآورد که برای روشهای حرارتی خطرناک هستند. مطالعات متعدد نشان دادهاند بافت آندوگراف (عروق و مجاری) پس از IRE سالم باقی میماند و فقط سلولهای اطراف تخریب میشوند. به طور مثال، پس از IRE تومورهای کبدی، تغییرات عروقی نادر بوده و اکثر عروق بزرگ پس از عمل سالم میمانند. همچنین تومورهای نزدیک مجاری صفراوی یا کیسه صفرا را میتوان بدون انسداد دائمی این ساختارها درمان کرد؛ فقط در موارد محدودی تضیق کوتاهمدت مجاری صفراوی دیده شده که معمولاً خودبهخود برطرف شده است.
در عین حال، برخی عوارض مرتبط با شرایط بیهوشی و کاشت الکترود وجود دارد:
- آریتمی قلبی: اگرچه گیتینگ ضربان قلب به طور چشمگیری خطر آریتمی را کاهش میدهد، در گزارشهای اولیه مواردی از آریتمی گذرا ثبت شده است. به همین دلیل در بیماران با سابقه اختلال ریتم یا پیسمیکر کاشتهشده از انجام IRE اجتناب میشود.
- انقباض عضلانی: با وجود بلوک عضلانی کامل، انقباضات موضعی عضلات در محل عبور الکترودها رخ میدهد، لذا اطمینان از فلج کامل عضلات بسیار مهم است.
- عوارض ناشی از کاشت الکترود: در مطالعات روی تومورهای کبدی گزارش شدهاند: پنوموتوراکس یا هموتوراکس اگر الکترودها از مجرای پلور خارج شوند، خونریزی محل پروب و تجمع مایع پلور و احتمالاً آبسه محل عبور پروب. این موارد غالباً عوارض درجه I–II هستند و به سرعت درمان میشوند.
- آسیب به اعصاب محیطی ناشی از وضعیت نامناسب بدن: در حین عمل IRE، بهویژه زمانی که بیمار تحت بیهوشی عمومی قرار دارد، اگر دستها یا دیگر اندامهای بدن بهدرستی در وضعیت مناسبی قرار نگیرند، ممکن است به اعصاب محیطی (مثلاً شبکه بازویی یا brachial plexus) آسیب وارد شود. این آسیبها معمولاً به دلیل کشیدگی یا فشار طولانیمدت روی اعصاب در حین پوزیشندهی بدن بیمار روی تخت جراحی رخ میدهند. چنین آسیبهایی میتوانند منجر به بیحسی، درد، یا ضعف موقتی در اندام شوند. در اغلب موارد، این حالتها طی چند روز تا چند هفته بهبود مییابند
- افزایش آنزیم: همانگونه که گفته شد، افزایش موقتی آنزیمهای کبدی و بیلیروبین معمول است. افزایش آنزیمهای پانکراسی کمتر گزارش شده است، ولی برخی بیماران افت عبور صفرا یا پانکراسیت ترانسینیتال مختصری داشتهاند. در پستان، مغز و سایر بافتها عوارض رایج نبوده است.
در مجموع، نرخ عارضه بالینی پس از IRE مشابه روشهای دیگر است. مثلاً در یک مرور سیستماتیک روی ۱۶ مطالعه با ۱۲۹ تومور کبدی، میزان کل عوارض ۱۶٪ و همه آنها درجه I–II گزارش شده است. در مطالعات بالینی پانکراس و پروستات نیز عمده عوارض مرتبط با خود عمل جراحی یا بیهوشی بوده و تخریب ناخواسته بافت مجاور بسیار کم است.
مزایا و محدودیتهای IRE
برای جمعبندی، مزایای اصلی و چالشهای IRE را می توان در جدول زیر خلاصه کرد.
| مزایا | محدودیتها |
| حفظ رگها و عصبهای مجاور (عدم تخریب بافت همبند) | نیاز به بیهوشی عمومی و بلوک عضلانی کامل |
| اثر غیرحرارتی (کمترین آسیب حین جریان در بافت) | مناسب تومورهای کوچک تا متوسط (معمولاً زیر ۳–۴ سانتیمتر) |
| امکان درمان تومورهای کنار عروق بزرگ | محدودیت در بیمارانی با آریتمی یا پیسمیکر کاشته (عدم همگامسازی) |
| اثر فوکال (مرز دقیق تخریب) و تحریک ایمنی محتمل | احتمال نیاز به تعبیه چندین الکترود (افزایش خطر عوارض کاشت) |
| امکان ترکیب با سایر درمانها (شیمیدرمانی) | تجربه محدود در برخی اندام (ریه، مغز) و نیاز به بررسی بیشتر |
جمع بندی
الکتروپوریشن برگشتناپذیر یک روش ابتکاری در درمان تومورهای جامد محسوب میشود که با اتکا به پالسهای الکتریکی غیرحرارتی، میتواند تومورهای دشوار را با حفظ ساختارهای حیاتی اطراف درمان کند. این روش بهویژه در اندامهایی مثل کبد، پانکراس و پروستات کاربرد دارد و مطالعات بالینی اولیه از ایمنی و اثربخشی آن خبر میدهند. هرچند هنوز نیاز به دادههای طولانیمدت بیشتر و تعیین دقیق استانداردهای درمانی وجود دارد، اما IRE به عنوان یک گزینه مکمل و گاه جایگزین در آرمان درمان سرطانهای موضعی در نظر گرفته میشود.
منابع:
Introduction to Irreversible Electroporation–Principles and Techniques
Design of an Irreversible Electroporation System for Clinical Use







