مدلسازی الکتروپوریشن برگشت ناپذیر برای بهینهسازی درمان سرطان پانکراس
این مقاله حاصل یک بازنویسی علمی و کاربردی از مقاله پژوهشی منتشر شده در مجموعه IFMBE Proceedings (جلد ۴۵) تحت عنوان «Modeling of Irreversible Electroporation Treatments for the Optimization of Pancreatic Cancer Therapies» نوشتهی E.L. Latouche و همکاران است. هدف از این بازنویسی، ارائه محتوای علمی به زبانی سادهتر و قابلفهم برای مخاطبان عمومی و تخصصی فارسیزبان است که علاقهمند به روشهای نوین درمان سرطان، بهویژه سرطانهای غیرقابل جراحی هستند.
الکتروپوریشن برگشت ناپذیر به عنوان یک روش درمانی نوین، امید تازهای برای درمان تومورهای غیرقابل جراحی فراهم کرده است. شرکت دانشبنیان پارستراوا به عنوان نخستین تولیدکننده دستگاه الکتروپوریشن در ایران، تلاش میکند با ارائه توضیحات علمی برگرفته از مقالات پژوهشی معتبر و ارائه نمونههای بالینی، شما را با توانمندیها و قابلیتهای این فناوری در درمان سرطانها و تومورهای پیشرفته آشنا سازد. هدف ما در پارستراوا، ارتقاء آگاهی جامعه پزشکی و بیماران و فراهم آوردن دسترسی به فناوریهای روز دنیا در درمان بیماریهای صعبالعلاج است.
.
معرفی سرطان پانکراس و روشهای درمانی رایج
سرطان پانکراس یکی از تهاجمیترین و مرگبارترین انواع سرطانهاست. شایعترین نوع آن، آدنوکارسینوم مجرای پانکراس (PDAC) است که در سلولهای پوشاننده مجرای پانکراس شکل میگیرد. این نوع سرطان معمولاً دیر تشخیص داده میشود و بههمین دلیل، نرخ بقاء پنجساله بیماران آن کمتر از ۵ درصد است.
درمانهای رایج برای سرطان پانکراس شامل موارد زیر هستند:
- جراحی: فقط در مراحل ابتدایی ممکن است امکانپذیر باشد و نرخ بقاء پنجساله در بهترین حالت به ۲۰–۲۵٪ میرسد.
- شیمیدرمانی و پرتودرمانی: برای کاهش اندازه تومور یا بهبود کیفیت زندگی به کار میروند، اما اثرات محدودی دارند.
- درمانهای ترکیبی (شیمیدرمانی همراه با جراحی یا پرتودرمانی): در برخی موارد نرخ بقاء را افزایش میدهند ولی همچنان در برابر تومورهای غیرقابل جراحی محدودیت دارند.
در این میان، روشهای غیرجراحی نوینی مانند الکتروپوریشن برگشت ناپذیر (IRE) مطرح شدهاند که امید تازهای برای درمان تومورهای غیرقابل برداشت ایجاد کردهاند.
الکتروپوریشن غیرقابل بازگشت (Irreversible Electroporation یا به اختصار IRE) یک روش غیرحرارتی و کمتهاجمی برای از بین بردن بافتهای سرطانی است که با استفاده از پالسهای کوتاه و شدید الکتریکی باعث ایجاد شکافهای نانومتری در غشای سلولها میشود. این شکافها به مرگ سلول منتهی میشوند بدون آنکه آسیب حرارتی شدیدی به بافتهای مجاور وارد شود. برخلاف روشهای حرارتی مانند فرکانس رادیویی یا لیزر، IRE توانایی حفظ عروق خونی و اعصاب حیاتی اطراف تومور را دارد. این ویژگی، آن را به گزینهای جذاب برای درمان تومورهایی تبدیل کرده که قابل جراحی نیستند، مانند سرطان آدنوکارسینوم مجرای پانکراس (PDAC).
ضرورت مدلسازی در IRE
برنامهریزی درمانی برای IRE نیازمند درک دقیق از رفتار میدان الکتریکی درون بافتهای پیچیده و ناهمگن بدن است. در بافتهایی مانند لوزالمعده که ساختاری بسیار پیچیده دارد و در مجاورت بافتها و عروق حساس قرار دارد، پیشبینی دقیق ناحیه ابلیشن (نابودی بافت) بدون شبیهسازی سهبعدی دقیق تقریباً غیرممکن است. در این مقاله، پژوهشگران مدلی سهبعدی از تومور پانکراس، لوزالمعده، رگهای خونی و بافتهای اطراف را با استفاده از تصاویر پزشکی (CT و MRI) بازسازی کردهاند تا بتوانند ابعاد ابلیشن، تأثیرات حرارتی، و ایمنی درمان را به دقت پیشبینی کنند.
روش تحقیق
در این بخش، فرایند فنی و گامبهگام مدلسازی و شبیهسازی روش الکتروپوریشن برگشت ناپذیر تشریح خواهد شد. از جمله مباحث مطرحشده میتوان به بازسازی سهبعدی تصاویر پزشکی، استفاده از نرمافزارهای تخصصی برای مشبندی، تعریف معادلات حاکم بر میدان الکتریکی و حرارتی، و مقایسهی آرایشهای مختلف الکترودها اشاره کرد. هدف از این بخش آن است که خواننده درک دقیقی از نحوه عملکرد علمی و عملی دستگاه الکتروپوریشن و معیارهای طراحی درمان بهدست آورد.
شبیهسازی و طراحی مدل سهبعدی
برای مدلسازی، تصاویر مقطعی از سه نما (محوری، ساژیتال، کرونال) تهیه شده و با استفاده از نرمافزار ParaView به فرمت مناسب برای تحلیل سهبعدی تبدیل شدند. سپس، مشبندی دقیق اجزای مختلف از جمله تومور، لوزالمعده، عروق خونی اصلی و الکترودها انجام شد. الکترودها با ضخامت 19 AWG و طول نمایان 1.5 سانتیمتر در نرمافزار SolidWorks طراحی شده و در جایگاههای مناسب قرار داده شدند. پس از آن مدل وارد نرمافزار COMSOL شد تا تحلیلهای عددی انجام شود.
.
ویژگیهای فیزیکی در مدلسازی
در این مدل، دو معادلهی اساسی مورد استفاده قرار گرفته است:
قانون لاپلاس
این قانون برای تعیین توزیع میدان الکتریکی در بافتها استفاده شده است. قانون لاپلاس به صورت زیر تعریف میشود:
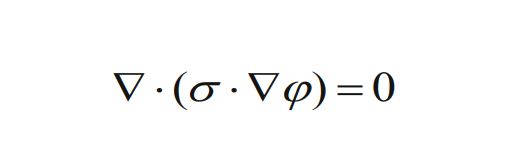
که در آن ϕ\phi پتانسیل الکتریکی است. با حل این معادله در هندسهی سهبعدی بدن، میتوان مشخص کرد که میدان الکتریکی در کدام نواحی از بافت از آستانهی لازم برای القای الکتروپوریشن (۵۰۰ ولت بر سانتیمتر) عبور کرده است. این پیشبینی برای تشخیص میزان موفقیت درمان و ایمنی آن ضروری است.
معادله پنه (Pennes Bioheat Equation)
برای ارزیابی اثرات حرارتی ناشی از پالسهای الکتریکی، از معادله پنه استفاده شده که انتقال گرما در بافت زنده را مدل میکند:
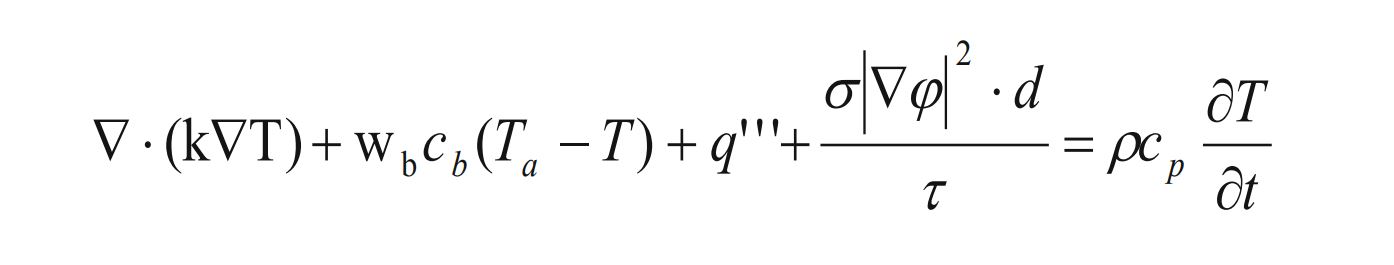
این معادله شامل پارامترهایی مانند نرخ پرفیوژن خون، ظرفیت گرمایی، گرمای متابولیک و گرمای خارجی است. در این مطالعه، اثرات حرارتی در مرکز ناحیه میان الکترودها بررسی شد تا اطمینان حاصل شود که افزایش دما در حدی نیست که مرگ حرارتی رخ دهد و مرگ سلولی بیشتر ناشی از الکتروپوریشن است.
پیکربندیهای مختلف الکترودها
سه پیکربندی مختلف برای الکترودها بررسی شد:
- دو الکترود با فاصله 2 سانتیمتر
- سه الکترود با فاصله 1.25 سانتیمتر
- چهار الکترود در یک آرایش مربعی (2×2 سانتیمتر)
.
نتایج شبیهسازی
درصد پوشش تومور در پیکربندیهای مختلف
بر اساس شبیهسازیها، میدان الکتریکی در بیشتر موارد فراتر از آستانه 500 ولت بر سانتیمتر بود که برای القای الکتروپوریشن کافی است. پیکربندی سهالکترودی توانست حدود 73 درصد از حجم تومور را ابلیشن کند، در حالی که پیکربندی دوالکترودی تنها حدود 39 درصد و چهارالکترودی حدود 59 درصد از تومور را نابود کردند.
جالب است که افزایش تعداد الکترودها الزاماً به بهبود نتایج منجر نمیشود؛ بلکه نحوه قرارگیری و فاصلهگذاری صحیح آنها اهمیت بیشتری دارد. دلیل این امر در چگونگی توزیع میدان الکتریکی نهفته است. اگر الکترودها بهدرستی نسبت به تومور جایگذاری نشوند یا فاصله آنها بیش از حد زیاد یا کم باشد، بخشی از بافت تومور ممکن است در معرض میدان کافی قرار نگیرد یا بافت سالم بیش از اندازه آسیب ببیند.
برای مثال، در این مطالعه پیکربندی سهالکترودی با فاصله مناسب توانست میدان یکنواختتری ایجاد کند و بیشترین پوشش تومور را فراهم کند، در حالی که چهار الکترود با چیدمان نامناسب باعث شد بخش بیشتری از پانکراس سالم درگیر شود بدون اینکه مزیت محسوسی در نابودی تومور داشته باشد.
نهایتاً، موفقیت در درمان وابسته به طراحی بهینهی چیدمان الکترودهاست نه صرفاً تعداد آنها. مدلسازی پیشدرمانی به پزشکان کمک میکند تا این طراحی را بر اساس شرایط واقعی هر بیمار انجام دهند.
بررسی اثرات حرارتی
همچنین اثرات حرارتی در مدل دوالکترودی بررسی شد و مشاهده شد که افزایش دمای قابلتوجهی در بافت رخ نمیدهد. این موضوع نشان میدهد که مرگ سلولی عمدتاً ناشی از الکتروپوریشن است نه گرما. بالاترین جریان ثبتشده در تمامی مدلها 40.1 آمپر بود.
.
مزایای مدلسازی پیش از درمان
این مدل به پزشکان اجازه میدهد تا پیش از انجام درمان، تأثیر پیکربندیهای مختلف الکترودها را روی پوشش تومور بررسی کنند و از تماس مستقیم الکترود با رگهای حیاتی جلوگیری نمایند. همچنین، امکان برآورد دقیقتری از ناحیه نابودی بافت و میزان آسیب به بافت سالم فراهم میشود. این اطلاعات به برنامهریزی بهینه، کاهش خطاهای درمانی و افزایش احتمال موفقیت در درمان کمک شایانی میکند.
.
جمعبندی و آیندهپژوهی
مطالعه حاضر نشان میدهد که طراحی مدلهای دقیق عددی بر پایه تصاویر پزشکی میتواند به پزشکان در انتخاب بهترین پروتکل درمانی برای بیماران مبتلا به سرطان پانکراس کمک کند. با این حال، برخی ملاحظات مانند اثر لایه اندوتلیال رگها و ویژگیهای الکتریکی متغیر بافت در طول درمان در این مدل لحاظ نشدهاند که در آینده باید بررسی شوند. همچنین تغییرات در هدایت الکتریکی در طول فرآیند الکتروپوریشن ممکن است منجر به گسترش بیشتر ناحیه ابلیشن شود که در این مدل محافظهکارانه در نظر گرفته شده است.
در آینده با انجام آزمایشهای تجربی بیشتر و استفاده از مدلهای هدایتپذیری پویا میتوان پیشبینیهای دقیقتری از تأثیر الکتروپوریشن ارائه کرد. همچنین بررسی همزمان اثرات حرارتی و الکتریکی و اثر آنها بر مکانیسم مرگ سلولی میتواند به درک بهتر از این روش منتهی شود.
الکتروپوریشن برگشت ناپذیر به عنوان یک روش درمانی نوین، امید تازهای برای درمان تومورهای غیرقابل جراحی فراهم کرده است و توسعه مدلهای عددی دقیق، راه را برای بهینهسازی این روش هموار میسازد.
منبع: